
Wetenschap
Nieuw op metallo-enzymen gebaseerd systeem maakt selectieve targeting van kankercellen mogelijk
RIKEN-onderzoekers hebben een veelbelovende methode ontwikkeld om een medicijn aan kankercellen af te geven zonder de omliggende weefsels aan te tasten. met een slimme combinatie van een kunstmatig metallo-enzym dat een metaalkatalysator beschermt, en een suikerketen die het metallo-enzym naar de gewenste cellen leidt.
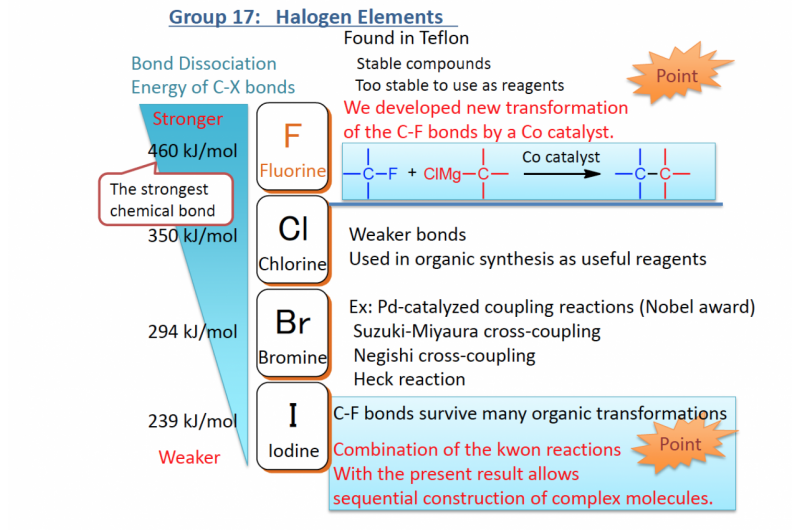
Op het gebied van organische synthetische chemie, veel metaalkatalysatoren zijn ontwikkeld met het vermogen om moleculen zoals medicijnen en functionele materialen te synthetiseren. Onlangs, onderzoekers zijn zich gaan concentreren op chemische reacties in levende lichamen die worden gekatalyseerd door overgangsmetalen — elementen die behoren tot de groepen drie tot en met elf op het periodiek systeem. Echter, ze zijn in de problemen gekomen:katalysatoren van overgangsmetalen zijn gemakkelijk te blussen - wat betekent dat ze worden geïnactiveerd door stoffen zoals antioxidanten - dus het was moeilijk om ze chemische reacties in werkelijke organismen te laten uitvoeren.
Het internationale onderzoeksteam, waaronder hoofdwetenschapper Katsunori Tanaka van het RIKEN Cluster for Pioneering Research en RIKEN Baton Zone Program en Special Postdoctoral Researcher Kenward Vong, heeft een kunstmatig metallo-enzym ontwikkeld dat een metaalion bevat en kan voorkomen dat het ion wordt uitgeblust. waardoor de chemische reactie in vivo kan plaatsvinden. Het metaalion was in dit geval ruthenium, die een "pro-drug" katalyseert in umbelliprenine, een van planten afgeleide verbinding waarvan bekend is dat ze antikankeractiviteit heeft. Verder, door een "afleverlabel" voor suiker aan het oppervlak van het kunstmatige metallo-enzym te bevestigen, ze waren in staat om het specifiek te richten op kankercellen waar het medicijn nodig was.
Om het werk uit te voeren, de groep werkte met een eiwit genaamd humaan serumalbumine, die overvloedig aanwezig is in het menselijk lichaam. De onderzoekers brachten een rutheniumkatalysator in de hydrofobe "zak" in het eiwit. Ze ontdekten dat in vitro, het ruthenium was in staat om chemische reacties uit te voeren. "We waren aangenaam verrast dat ons nieuw ontwikkelde metallo-enzym goed werkte in de aanwezigheid van glutathion, een antioxidant die overvloedig aanwezig is in werkelijke cellen en ruthenium kan inactiveren. Dit vertelde ons dat de rutheniumkatalysator goed beschermd is tegen hydrofiele componenten zoals glutathion in de hydrofobe pocket van het albuminemolecuul, terwijl hydrofobe verbindingen in contact kunnen komen met de katalysator in de zak en katalyse ondergaan, " zegt Tanaka, die de groep leidde.
Na te hebben vastgesteld dat de katalyse zou werken, de onderzoekers veranderden het oppervlak van het albumine, suikerketens vastmaken waardoor het naar specifieke cellen van belang kon worden getransporteerd. Doelcellen worden herkend aan het patroon van suikerketens. Dit doen, ze hebben met succes de katalysator aan kankercellen afgeleverd, en gebruikte het om umbelliprenine te produceren, waarvan ze vaststelden dat het cytotoxische effecten had op de kankercellen.
"We hebben bevestigd dat de methode die we hebben ontwikkeld kan worden toegepast op door metaal gekatalyseerde reacties met behulp van andere katalysatoren zoals goud, en het kunstmatige metallo-enzym zou over het algemeen in vivo kunnen worden gebruikt, " voegt Tanaka toe. "Als katalyse van overgangsmetalen kan worden uitgevoerd op specifieke organen of zieke cellen in het lichaam, het zal ons in staat stellen om daar snel en stabiel medicijnen te synthetiseren, bijwerkingen minimaliseren. Onze bevindingen zouden een sleutel kunnen worden in de strijd tegen dergelijke ziekten. Verder, we kunnen overwegen om andere natuurlijke verbindingen te gebruiken, die een sterke antikankeractiviteit vertonen, maar tot dusver niet zijn gebruikt. We hebben een deur geopend naar een nieuw tijdperk waarin we natuurlijke chemische verbindingen in echte organismen kunnen synthetiseren en activeren."
Het onderzoek wordt gerapporteerd in Natuur Katalyse .
 Kalium geeft op perovskiet gebaseerde zonnecellen een efficiëntieboost
Kalium geeft op perovskiet gebaseerde zonnecellen een efficiëntieboost Screening op macrocyclische peptiden
Screening op macrocyclische peptiden Gepersonaliseerde kankervaccins:doorbraak kan betere resultaten opleveren
Gepersonaliseerde kankervaccins:doorbraak kan betere resultaten opleveren Wat is de vergelijking voor het vinden van de begintemperatuur?
Wat is de vergelijking voor het vinden van de begintemperatuur?  Hoe beïnvloedt de temperatuur de activiteit van Catalase-enzym?
Hoe beïnvloedt de temperatuur de activiteit van Catalase-enzym?
 Soorten wilde knaagdieren in Ohio
Soorten wilde knaagdieren in Ohio  Nieuw licht in de recente evolutie van de Afrikaanse spleetvallei
Nieuw licht in de recente evolutie van de Afrikaanse spleetvallei In de VS, kleine biologische melkproducenten kampen met onrust
In de VS, kleine biologische melkproducenten kampen met onrust Langetermijnstudie heeft tot doel de ecologie van prairies te begrijpen nadat landbouwgrond is verlaten
Langetermijnstudie heeft tot doel de ecologie van prairies te begrijpen nadat landbouwgrond is verlaten Onderdelen van de waterkoeler kunnen een bron zijn van blootstelling aan organofosfaatesters
Onderdelen van de waterkoeler kunnen een bron zijn van blootstelling aan organofosfaatesters
Hoofdlijnen
- Gewonde zeeschildpad genezen met 3D-printen
- Is er een gen voor elke ziekte?
- Een nieuwe rol voor insuline als vitale factor bij het in stand houden van stamcellen
- Nieuw model bevestigt dat bedreigde rechtse walvissen afnemen
- De eigenschappen van steenzout
- Verschillen en overeenkomsten tussen eencellig en cellulair
- Wat is het pad van het licht door het oog?
- Het effect van zout en suiker op gedehydrateerde cellen
- Nieuwe vlindersoort ontdekt in Rusland met een ongewone set van 46 chromosomen
- Chemici bouwen nieuwe chemische structuren op niet-reactieve bindingen
- E-waste transformeren in een sterk, beschermende coating voor metaal

- Poreuze kristallen gebruiken om licht te oogsten
- Modificatie van aminozuren biedt nieuw startpunt voor ontwikkeling van medische behandelingen

- Onderzoek bevordert de duurzaamheid van de productie van chirurgische latexhandschoenen

 Spel is over? China houdt online games in bedwang bij laatste tegenslag in de industrie
Spel is over? China houdt online games in bedwang bij laatste tegenslag in de industrie Revolutionaire ultradunne metalen lens maakt beeldvorming in kleur mogelijk
Revolutionaire ultradunne metalen lens maakt beeldvorming in kleur mogelijk Hoe houdt een piepschuim-koeler de dingen koud?
Hoe houdt een piepschuim-koeler de dingen koud?  Barrière voor snellere grafeenapparaten geïdentificeerd en onderdrukt
Barrière voor snellere grafeenapparaten geïdentificeerd en onderdrukt Seleniumtekort bevorderd door klimaatverandering
Seleniumtekort bevorderd door klimaatverandering Wetenschappers ontwikkelen grafeensensoren die een revolutie teweeg kunnen brengen in het internet der dingen
Wetenschappers ontwikkelen grafeensensoren die een revolutie teweeg kunnen brengen in het internet der dingen Ruimtemijnbouw is geen sciencefiction, en Canada zou een prominente rol kunnen spelen
Ruimtemijnbouw is geen sciencefiction, en Canada zou een prominente rol kunnen spelen De beweging van een enkel nanodeeltje volgen
De beweging van een enkel nanodeeltje volgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

