
Wetenschap
Engineering ECM-achtige vezels met bioactieve zijde voor 3D-celkweek
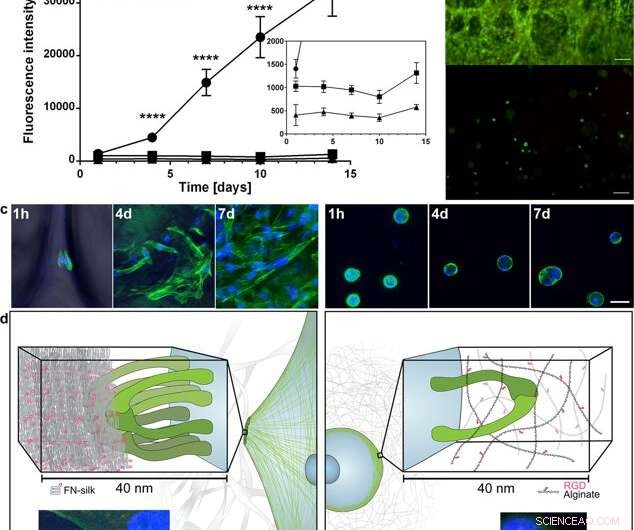
Verspreiding en expansie van cellen in FN-zijde vergeleken met wanneer ingekapseld in een RGD-gekoppelde hydrogel. (a) Representatieve grafiek (gemiddelde en standaarddeviatie) van de levensvatbaarheidstest van Alamar Blue die de metabole activiteit van fibroblasten (HDF) in FN-zijdeschuim (cirkel) toont, een zeer lage viscositeit (VLVG) alginaat hydrogel gekoppeld aan RGD (vierkant), en een alginaathydrogel met gemiddelde viscositeit (MVG) gekoppeld aan RGD (driehoek) gedurende twee weken kweken. Invoegen toont een ingezoomde weergave van de lagere intensiteiten. Statistieken (studenten-t-test op elk tijdstip):**** geeft p < 0.0001 (n = 12) aan (b) Representatieve levende (groen) en dode (rode) kleuring van menselijke mesenchymale stamcellen (HMSC) in FN- zijdeschuim (boven) en RGD-gekoppeld alginaat VLVG (onder) op dag 14. Schaalbalken = 100 µm. (c) Confocale scans van HMSC's geïntegreerd in FN-zijdeschuim (linker paneel), en RGD gekoppelde alginaathydrogel MVG (rechterpaneel) na 1 h, 4 dagen en 7 dagen. Actinefilamenten worden gevisualiseerd door phalloidin-kleuring (groen) en celkernen worden gekleurd met DAPI (blauw). Schaalbalken = 20 m. ( d ) Schematische beschrijving van de hypothese voor de reden achter het waargenomen verschil in interacties tussen cellen en zijde (links) versus RGD-gekoppelde alginaathydrogels (rechts). Verschillende integrineparen (groen) kunnen zich hechten en verzamelen aan de zijden microvezels, vorming van focale verklevingen aan de rand van actinefilamenten, waardoor de cellen zich kunnen verspreiden en prolifereren. In de alginaathydrogel, een enkel integrinepaar (groen) kan binden aan het gekoppelde RGD-motief, maar de dunne alginaatketens beperken het daaropvolgende verzamelen in focale verklevingen. Inserts tonen voorbeelden van een cel (fibroblast) na 3 h in FN-zijdeschuim (links) en een lage viscositeit (VLVG) alginaathydrogel gekoppeld aan RGD (rechts). Actinefilamenten worden gevisualiseerd door phalloidin-kleuring (groen), en focale verklevingen kunnen worden gezien waar dit co-gelokaliseerd is met kleuring voor vinculine (rood, gemarkeerd met pijl). Celkernen worden gekleurd met DAPI (blauw). Krediet:wetenschappelijke rapporten, doi:10.1038/s41598-019-42541-y
Biologische weefsels worden gebouwd wanneer cellen verankeren op specifieke plaatsen op een 3D-microvezelnetwerk in een extracellulaire matrix (ECM). Wetenschappers willen graag biologische weefsels recreëren in het laboratorium met behulp van bio-geïnspireerde tissue engineering en genetische manipulatie, om functionele ECM-motieven te vormen die zijn gefuseerd met recombinante zijde-eiwitten. Onder adequate fysiologische omstandigheden, biologisch gemanipuleerde zijde-eiwitten en fibronectine-zijde (FN-zijde) kunnen zichzelf assembleren tot microvezelnetwerken die native ECM nabootsen.
In een recente studie, Ulrika Johansson, Mona Widhe en medewerkers van de interdisciplinaire afdelingen Biotechnologie, Chemie van biomaterialen, en Immunologie in Zweden hebben een methode ontwikkeld om zoogdiercellen in een zijdeoplossing op te nemen voordat zijde in constructies wordt geassembleerd, om uniforme celgeïntegreerde weefselachtige microvezels te vormen. De resulterende 3D-steigerconstructies vertoonden verbeterde celproliferatie (groei) en homogene celverspreiding in vergelijking met cellen ingekapseld in hydrogel. De resultaten van het onderzoek zijn nu gepubliceerd in Wetenschappelijke rapporten .
De wetenschappers bevestigden celhechting op fibronectine-zijdeconstructies (FN-Silk) in het werk door filamenteuze actine te observeren en door focale adhesiepunten van de aangehechte, langwerpige cellen. Ze behielden de levensvatbaarheid van de cellen gedurende 90 dagen in de cel-FN/zijde-oppervlakken en toonden schaalbaarheid van de methode tot 3D-celculturen van macroformaat. De zijden microvezelbundels met ingekapselde cellen behielden de biomechanische sterkte en uitbreidbaarheid, net als menselijke arteriële wanden.
Het protocol ontwikkeld door Johansson en Widhe et al. lieten ook stamcellen toe om te differentiëren in de 3D-constructen om de groei van diverse co-culturen van cellen te ondersteunen. Ze toonden aan dat endotheelcellen kunnen worden opgenomen in de bio-geïnspireerde materialen om vaatachtige structuren door de weefselconstructies te vormen. De wetenschappers stellen zich voor om het ECM-achtige netwerk te gebruiken als basis voor toekomstige inspanningen om functionele biologische weefsels in het laboratorium te ontwikkelen.
In vitro zoogdiercelcultuur is een onmisbare experimentele techniek in fundamenteel onderzoek en industriële toepassingen, hoewel het bestaande proces voor het gemak afhankelijk is van 2D-oppervlakken van hard plastic of glas, waardoor de natuurlijke biologische respons wordt aangetast. Omdat biologische cellen van nature gewend zijn om signalen uit de 3D-omgeving te ontvangen, weefselingenieurs hebben nieuwe experimentele strategieën ontwikkeld met behulp van 3D-celculturen. De experimentele omstandigheden handhaafden celadhesie, proliferatie en differentiatie om het celmetabolisme en de functionaliteit in het laboratorium te recreëren en te ondersteunen.
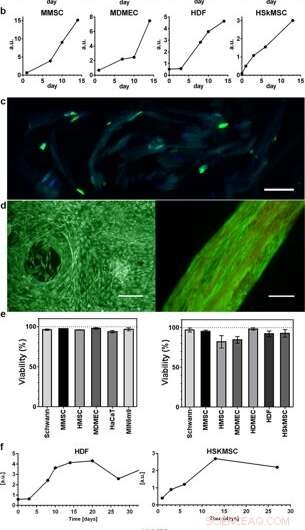
Proliferatie en levensvatbaarheid van cellen geïntegreerd in 3D-zijde. Representatieve grafieken van de Alamar Blue-levensvatbaarheidstest laten een toenemende metabole activiteit zien gedurende de eerste 2 weken binnen (a) schuim (N = 3–4, n = 3–7), en (b) vezels (N = 1–9, n = 2-13), als gevolg van de groei van de verschillende geïntegreerde celtypen (HaCaT; humane keratinocytcellijn, HDF; menselijke dermale fibroblasten, MDMEC; muis dermale microvasculaire endotheelcellen, MIN6m9; insuline-afscheidende muis pancreas -cellijn). (c) Celdeling vindt plaats diep in de 3D-zijde. Cryosectie van een vezel met geïntegreerde fibroblasten (HDF) gefixeerd op dag 11 en gekleurd met FITC-anti BrdU voor nieuw gesynthetiseerd DNA (groen) en DAPI (blauw). De zijde vertoont een vage autofluorescentie in het blauw/groene bereik. ( d ) Representatieve levende (groene) en dode (rode) kleuring van mesenchymale stamcellen van muizen (MMSC) in schuim (links) en HDF in vezels (rechts) op dag 14. De vezel vertoont een vage autofluorescentie in het rode bereik. Schaalbalken = 100 µm. (e) Levensvatbaarheid (%, gemiddelde en standaarddeviatie) na 14 dagen kweken van verschillende celtypes (zie suppl. tabel 1) in schuim (linker grafiek), en in vezels (rechter grafiek) (N = 1–3, n = 4). (f) Lange tijdculturen van cellen geïntegreerd in vezels handhaafden metabolische activiteit (Alamar blauw) gedurende de gehele onderzoeksperiode (tot 97 dagen). Krediet:wetenschappelijke rapporten, doi:10.1038/s41598-019-42541-y
Eerder, Johansson en Widhe et al. een schaalbaar proces had ontwikkeld om het recombinante spinnenzijde-eiwit, bekend als 4RepCT, te ontwikkelen voor bio-geïnspireerde celkweek in het laboratorium, die zelf-geassembleerd in biologisch afbreekbare en biocompatibele microvezels in waterige, fysiologische buffers bij kamertemperatuur. Ze functionaliseerden het nieuwe construct met behulp van een celadhesiemotief van fibronectine (FN) om het FN-zijdemateriaal te vormen en een stevige celhechting te bevorderen. Hoewel cellen zich verspreidden langs de nieuwe materiaaloppervlakken, ze bleven alleen aan de oppervlakte, niet in staat om zich in de constructen te prolifereren om weefselachtige eigenschappen in vitro adequaat na te bootsen. In het huidige werk, de wetenschappers ontwikkelden daarom een nieuwe methode, om cellen efficiënt in het zijdemateriaal in te bedden tijdens de assemblage van FN-zijde voor ingekapselde en levensvatbare 3D-celcultuur die de extracellulaire matrix in vitro adequaat nabootste.
Tissue engineering cel-ingebedde zijde constructies in het lab
Tijdens de experimenten, Johansson en Widhe et al., eerst een druppel gedispergeerde stamcellen toegevoegd (mesenchymale muisstamcellen, MMSC) aan de FN-zijde-eiwitoplossing voorafgaand aan de assemblage van de oplossing. Na incubatie, het nieuw gevormde netwerk bleef stabiel in kweekmedia en het aantal ingekapselde cellen nam toe in de constructen gedurende de kweekperiode. Na drie dagen, de cellen verspreiden zich over alle dimensies van het schuim, die de wetenschappers observeerden met behulp van differentiële interferentiecontrast (DIC) microscopie.
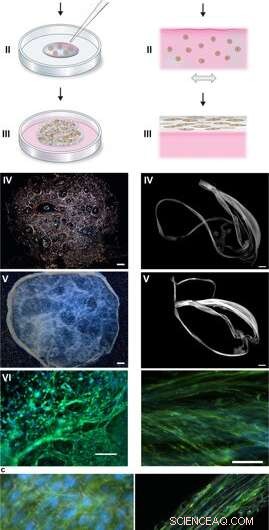
Zijdemontage om cellen te integreren in een 3D-netwerk van microvezels. (a) Schematische beschrijving van de vorming van zijdeschuim met ingesleten cellen. Cellen gesuspendeerd in kweekmedium (roze) worden toegevoegd aan een gedefinieerde druppel FN-zijde-eiwitoplossing (blauw) die in het midden van een niet-behandeld kweekputje (I) is geplaatst. Luchtbellen worden snel ingebracht (5-10 sec) via een pipetpunt (II), om een 3D-schuim met cellen te laten ontstaan. Na 30 minuten in de celincubator, extra kweekmedium wordt toegevoegd om het schuim volledig te bedekken (III). Dag 1 na formulering, het zijdeschuim met cellen ziet er bijna transparant uit, hoewel ze enkele resterende luchtbellen herbergen (die met de tijd verdwijnen) (IV). Na 2 weken kweken, het schuim met geïntegreerde cellen ziet er dichter en witter uit (V). Al op dag 3 is het schuim gevuld met goed gespreide cellen (hier worden mesenchymale stamcellen van de muis (MMSC) getoond) (VI). Actinefilamenten worden gevisualiseerd door phalloidin (groen) en celkernen door DAPI-kleuring (blauw). Schaalbalk IV-V = 1 mm, VI = 100 µm. (b) Schematische beschrijving van zijdevezels gevormd met geïntegreerde cellen. Cellen gesuspendeerd in medium (roze) worden toegevoegd aan de FN-zijde-eiwitoplossing (blauw) (I). Tijdens zacht herhaald uniaxiaal kantelen gedurende 1-3 uur (II) assembleren de zijde-eiwitten aan het lucht-vloeistofgrensvlak tot een macroscopische bundel microvezels met ingebouwde cellen (III). De zijdevezels met cellen zijn gemakkelijk terug te vinden (IV) en kunnen in een put worden geplaatst voor verdere kweek, waarbij de dikte over 2 weken toeneemt (V). Op dag 3, uitgelijnde cellen (hier MMSC) worden gevonden verspreid geïntegreerd in de vezelbundel (VI). Actinefilamenten worden gevisualiseerd door phalloidin (groen) en celkernen door DAPI-kleuring (blauw). Schaalbalk IV-V = 1 mm, VI = 100 µm. (c) Differentiële interferentiecontrast (DIC) microfoto's van de zijden microvezels (wit) in een vezel (links) en een schuim (rechts) met geïntegreerde cellen (MMSC). Actinefilamenten worden gevisualiseerd door phalloidin (groen) en celkernen door DAPI-kleuring (blauw). Schaalbalk = 50 m (links) en 100 m (rechts). Krediet:wetenschappelijke rapporten, doi:10.1038/s41598-019-42541-y
Ze leidden de celuitlijning om een willekeurig 3D-netwerk van microvezels te vormen dat met succes biologische weefsels nabootste door een macroscopische bundel microvezels te vormen tijdens de tijdlijn van celcultuur, gevolgd door onderzoek van de cel tot ECM-verhouding. De wetenschappers varieerden de ECM tot celsamenstelling om een reeks weefseltypes na te bootsen of te matchen, met inbegrip van schaarse cellen en weefsels met een hoge dichtheid van de lever. De methode is daarom ook geschikt voor 3D-celkweek met minieme celhoeveelheden.
De levensvatbaarheid van cellen testen op de zijden steigers - cytocompatibiliteitsstudies
De wetenschappers gebruikten groeiprofielen om de verschillende celtypen in kaart te brengen die zijn ingebed in zowel schuim als vezels van de zijde-assemblage. Ze observeerden een verhoogd signaal van de metabole activiteit om celproliferatie in de 3-D zijden scaffolds weer te geven en na verloop van tijd vertoonden ze een verhoogde celdichtheid in de binnenste cel-zijde scaffold. Johansson et al. onderzocht celproliferatie met behulp van BrdU-kleuring, waar positieve resultaten een diepere proliferatie en celverspreiding in de zijdevezels aantoonden om de levensvatbaarheid van de cellen te behouden na 2 weken inkapseling, en tijdens langdurige celkweekperiodes van één tot drie maanden.
Vergelijking van de cytocompatibiliteit van zijde versus hydrogel-biomaterialen
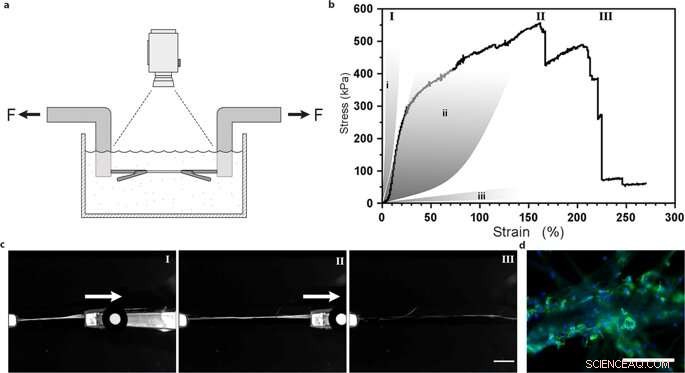
Uni-axiale trekproeven van zijdevezels met geïntegreerde mesenchymale stamcellen. (a) Illustratie van de experimentele opstelling voor trekproeven uitgevoerd in PBS-buffer bij 37 ° C om levensvatbare cellen te behouden. ( b ) Representatieve eerste Piola-Kirchhoff-stress versus rekcurve van een FN-zijdevezel met geïntegreerde mesenchymale stamcellen (MMSC) onderworpen aan trekproeven na 14 dagen kweken. Spanning-rekcurve illustreert een nogal lineaire (en waarschijnlijk elastische) fase die wordt gevolgd door een plastische (onomkeerbare) vervormingsfase totdat de maximale spanning is bereikt, en de vezel breekt. Ter vergelijking, grijze gebieden vertegenwoordigen bereiken van stress-rekeigenschappen in pezen en ligamenten (i), slagaderwanden (ii), en hersenweefsel (iii). Romeinse cijfers verwijzen naar afbeeldingen (c) genomen tijdens de trekproef, d.w.z. tijdens start (I), verlenging (II) en breuk (III) van de vezels. Schaalbalk = 5 mm. (d) Microfoto's van het breekpunt van vezels met MMSC's na trekproeven. Actinefilamenten worden gevisualiseerd door phalloidin-kleuring (groen) en celkernen worden gekleurd met DAPI (blauw). Schaalbalken = 200 m. Krediet:wetenschappelijke rapporten, doi:10.1038/s41598-019-42541-y
Op basis van de bemoedigende voorlopige resultaten, de wetenschappers voerden parallelle experimenten uit om celgroei in zijde te vergelijken met celgroei in hydrogel om de cytocompatibiliteit van de twee materialen te bepalen. Ze kozen alginaat om de hydrogel weer te geven tijdens celkweek en observeerden verschillen tussen alginaat en zijde, opname van duidelijke celuitbreiding in zijde, terwijl cellen in alginaat in een stabiele metabolische toestand bleven. Met behulp van confocale microscopie, ze onderzochten de redenen voor het waargenomen verschil in celgroei op het niveau van de micro-omgeving. De resultaten toonden snelle celhechting (gezien met langwerpige cellen) in de zijdeconstructies, terwijl de alginaatconstructies samentrokken tijdens celkweek, die de cellen mogelijk hebben gestrest om los te komen.
Biomechanische studies - karakterisering van de nieuwe materialen
Ze bepaalden dat de stijfheid van het materiaaloppervlak een cruciale component was die het lot van de cel beïnvloedde. Om deze waarneming te verifiëren, Johansson et al. getest biomechanisch gedrag van de zijdeconstructies om ervoor te zorgen dat ze het natuurlijke weefsel adequaat nabootsten. Ze voerden trekproeven uit in een fysiologische buffer om de resultaten te verkrijgen, wat aantoonde dat de mechanische eigenschappen van zijdebevattende cellen overeenkwamen met die van bindweefsel zoals slagaderwanden. Johansson et al. waren in staat om hoge uitbreidbaarheid van de microvezels aan te tonen om krachtovergang in en door de cellen die aan het nieuwe biomateriaal zijn gehecht aan te geven - wat een adequate celhechting bevestigt.
Biofunctionalisatiestudies - onderzoek naar biocompatibiliteit van het oppervlak in vitro
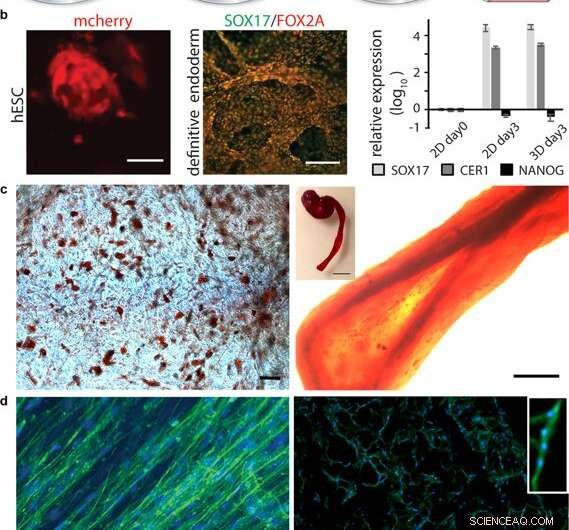
Differentiatie van cellen in 3D-zijde. (a) Na initiële uitbreiding van stamcellen geïntegreerd in 3D-zijde, differentiatie in verschillende weefseltypes kan worden veroorzaakt door toevoeging van geschikte factoren. (b) Differentiatie van pluripotente stamcellen. Links:menselijke embryonale stamcellen (hESC) gevisualiseerd door mCherry-detectie bij 48 h na celintegratie in FN-zijdeschuim. Schaalbalk = 50 m. Midden:Immunokleuring voor endodermale markers SOX17 (groen) en FOX2A (rood) na 3 dagen differentiatie. Schaalbalken = 200 m. Rechts:genexpressie (SOX17, CER1, NANOG) van hESC in een FN-zijdeschuim vergeleken met 2D-cultuur, geanalyseerd met RT-qPCR op dag 3 van endodermale inductie. Staven vertegenwoordigen de gemiddelde vouwverandering ± standaarddeviatie (n = 4). (c) Differentiatie van multipotente volwassen stamcellen. Links:Menselijke mesenchymale stamcellen (HMSC) in FN-zijdeschuim gedifferentieerd in de adipogene lijn die lipiden bevat, gevisualiseerd door rode oliekleuring (rood) (N = 2, n = 4). Schaalbalk = 100 µm. Rechts:HMSC's gedifferentieerd in de osteogene lijn, gesondeerd met osteogene marker voor calciumgehalte (Alizarin Red S (rood) in FN-zijdevezel (rechts, schaalbalk = 200 µm), (N = 2, n = 4). Inzet toont foto van een hele vezel (rechts), schaalbalk = 1 mm). (d) Differentiatie van volwassen voorlopercellen. Links:na 14 dagen in differentiatiemedia, skeletspiersatellietcellen (HSkMSC) in een FN-zijdevezel vertonen prominente actinefilamenten, zoals gevisualiseerd door phalloidin-kleuring (groen). Rechts:Myogene differentiatie van skeletspiersatellietcellen (HSkMSC) gevisualiseerd door Desmin-kleuring (groen). DAPI-gekleurde kernen in blauw. (N = 9, n = 4). Schaalbalken = 200 m. Een close-up van het gebied van een multinucleaire myotube wordt getoond in de rechterbovenhoek. Krediet:wetenschappelijke rapporten, doi:10.1038/s41598-019-42541-y
Na het vaststellen van biomechanische stabiliteit, de wetenschappers testten of de stamcellen die op de zijden steigers groeiden, konden differentiëren (rijpen) op hetzelfde materiaal. Voor deze, ze gebruikten pluripotente en multipotente menselijke embryonale stamcellen in de celkweektesten, gevolgd door het kwantificeren van genexpressie van biologische markers van celgroei; FOXA2 (metabole genen), SOX17 (genen voor embryonale ontwikkeling en bepaling van het lot van de cel), CER1 (botmorfogenetische eiwitantagonisten) en NANOG (embryonale stamcelproliferatie, pluripotentie en vernieuwing). Bij de resultaten, zowel SOX17 als CER1 vertoonden robuuste opregulatie, terwijl de biomarker van pluripotentie (NANOG) afnam als gevolg van celrijpheid als gevolg van het verlies van pluripotentie.
De wetenschappers testten de biofunctionalisatie van het oppervlak voor verschillende celtypen, waaronder menselijke skeletspiersatellietcellen (HSkMSC) en van beenmerg afgeleide menselijke mesenchymale stamcellen (hMSC). Na celexpansie op de constructen, de wetenschappers zouden het lot van de hMSC's kunnen sturen in adipogene of osteogene cellijnen. Aanvullend, na twee weken celkweek, Johansson et al. toonde myogene differentiatie van de HSkMSC's om prominente actinefilamenten te vormen, en de spierspecifieke marker desmine uitdrukken, om de rijping van de myotube in vitro te verifiëren.
Biologische vaten ontwerpen in het lab
De wetenschappers combineerden vervolgens endotheelcellen in het 3D-vasculaire netwerk om bindweefsel te vormen dat de inherente cellulaire organisatie van microvaten in het laboratorium nabootste. Ze volgden hetzelfde protocol met behulp van zijdeassemblage met celintegratie en voegden een fractie endotheelcellen toe om het bindweefsel te manipuleren. Over twee weken, ze observeerden dat de cellen zich verzamelden en millimeterlange vertakte spruiten en vaatachtige structuren vormden met prominente ringen van endotheelcellen in de zijdevezels. De wetenschappers zouden de grootte van de constructies op schaal kunnen vergroten en de uitlijning en aggregatie van verschillende celtypen kunnen bepalen.
Op deze manier, Johansson en Widhe et al. demonstreerde een nieuwe strategie en ontwikkelde een protocol om in functionele cellen binnen 3D-netwerken te passen die de vezelachtige architectuur van de inheemse extracellulaire matrix (ECM) nabootsten. Om het experiment te bemiddelen, ze gebruikten zelf-assemblerende recombinante zijde-eiwitten en toonden aan dat een verscheidenheid aan cellen kon worden ingebed in de 3D-constructen. De installatie en het protocol zijn eenvoudig en kosteneffectief, in tegenstelling tot 3D-printen is het proces zuinig en hands-on, zonder dure machines. De wetenschappers streven ernaar dit protocol te optimaliseren en te standaardiseren om biocompatibele, geavanceerde zijdematerialen in tissue engineering. Het experimentele werk zal een breed scala aan toepassingen hebben in de materiaalwetenschap als miniatuur in vitro-modellen voor de ontwikkeling van geneesmiddelen en als grotere biotechnologische weefselconstructies in regeneratieve geneeskunde.
© 2019 Wetenschap X Netwerk
 Dit molecuul is gemaakt van suiker, in de vorm van een donut, en gevormd met behulp van licht
Dit molecuul is gemaakt van suiker, in de vorm van een donut, en gevormd met behulp van licht Een nieuwe formule voor het creëren van chemische reacties - met koolhydraten
Een nieuwe formule voor het creëren van chemische reacties - met koolhydraten Wat is het verschil tussen blauw en rood lakmoespapier?
Wat is het verschil tussen blauw en rood lakmoespapier?  Hoe chloor next-gen zonnecellen stabiliseert op atomaire schaal
Hoe chloor next-gen zonnecellen stabiliseert op atomaire schaal Nieuwe methode berekent evenwichtsconstante op kleine schaal
Nieuwe methode berekent evenwichtsconstante op kleine schaal
 Pannenkoekenijs:de ijsformatie die niet over ontbijt gaat
Pannenkoekenijs:de ijsformatie die niet over ontbijt gaat  Het oude Groenland was veel warmer dan eerder werd gedacht
Het oude Groenland was veel warmer dan eerder werd gedacht VK belooft uitstoot met meer dan driekwart te verminderen tegen 2035
VK belooft uitstoot met meer dan driekwart te verminderen tegen 2035 Realtime monitoring kan de wateradviezen van de First Nations met een derde verminderen, studie vondsten
Realtime monitoring kan de wateradviezen van de First Nations met een derde verminderen, studie vondsten Kustbestendigheid gekoppeld aan nationale veiligheid
Kustbestendigheid gekoppeld aan nationale veiligheid
Hoofdlijnen
- Het magische medicijn van Bezoars
- Nieuwe studie wijst op onverwachte voordelen van rabiësvaccinatie bij honden
- Signaaltransductie: definitie, functie, voorbeelden
- Hoop op een van 's werelds zeldzaamste primaten:eerste telling van Zanzibar Red Colobus-aap
- Voeding die de productiviteit in de intensieve veehouderij verhoogt
- Koeltechnologie om de levensvatbaarheid van het gekoelde muizensperma gedurende 10 dagen te behouden
- Wat zijn schadelijke genen?
- Bron van Beperking Enzymes
- Wat zit er in je tarwe? Wetenschappers voegen het genoom van de meest voorkomende broodtarwe samen
 Appel, Google zet inclusieve push voort met nieuwe emoji
Appel, Google zet inclusieve push voort met nieuwe emoji As tot as, stof tot ... compost? Een milieuvriendelijke begrafenis in slechts 4 weken
As tot as, stof tot ... compost? Een milieuvriendelijke begrafenis in slechts 4 weken Chemici vinden nieuwe manier om oude banden af te breken tot materiaal voor nieuwe
Chemici vinden nieuwe manier om oude banden af te breken tot materiaal voor nieuwe Opvallen:ongebruikelijke magnetische overgang in perovskietoxide kan spintronica helpen stimuleren
Opvallen:ongebruikelijke magnetische overgang in perovskietoxide kan spintronica helpen stimuleren Hoe kan ik uitleggen hoe magneten werken voor kleuters?
Hoe kan ik uitleggen hoe magneten werken voor kleuters?  De geschiedenis laat zien dat samenlevingen instorten wanneer leiders sociale contracten ondermijnen
De geschiedenis laat zien dat samenlevingen instorten wanneer leiders sociale contracten ondermijnen Rock Candy Science Project
Rock Candy Science Project  Foxconn importeert mogelijk werknemers voor fabriek in VS:rapport
Foxconn importeert mogelijk werknemers voor fabriek in VS:rapport
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






