
Wetenschap
Nieuwe aanpak voor het oplossen van eiwitstructuren uit minuscule kristallen
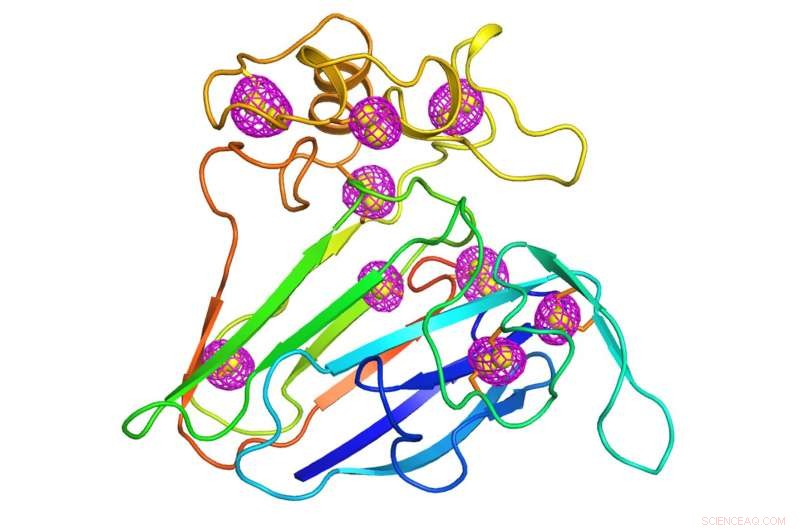
Een cartoon die de structuur weergeeft van een goed bestudeerd plantaardig eiwit dat diende als testcase voor de nieuw ontwikkelde microkristallografietechniek. Magenta mesh-patronen rond zwavelatomen die intrinsiek zijn aan het eiwit (gele bollen) geven de afwijkende signalen aan die werden geëxtraheerd met behulp van energiezuinige röntgendiffractie van duizenden kristallen van minder dan 10 miljoenste van een meter, de grootte van een bacterie. Krediet:Brookhaven National Laboratory
Het gebruik van röntgenstralen om de 3D-structuren van eiwitten op atomaire schaal te onthullen heeft geleid tot talloze vorderingen in het begrijpen hoe deze moleculen in bacteriën werken, virussen, planten, en mensen - en heeft geleid tot de ontwikkeling van precisiegeneesmiddelen om ziekten zoals kanker en aids te bestrijden. Maar veel eiwitten kunnen niet worden gekweekt tot kristallen die groot genoeg zijn om hun atomaire rangschikkingen te ontcijferen. Om deze uitdaging aan te gaan, wetenschappers van het Brookhaven National Laboratory van het Amerikaanse Department of Energy (DOE) en collega's van Columbia University hebben een nieuwe benadering ontwikkeld voor het oplossen van eiwitstructuren uit kleine kristallen.
De methode is gebaseerd op unieke monsterbehandeling, signaal-extractie, en data-assemblage benaderingen, en een bundellijn die intense röntgenstralen kan focussen op Brookhaven's National Synchrotron Light Source II (NSLS-II) - een DOE Office of Science gebruikersfaciliteit - tot een miljoenste van een meter plek, ongeveer een vijftigste van de breedte van een mensenhaar.
"Onze techniek opent echt de deur naar het omgaan met microkristallen die voorheen ontoegankelijk waren, inclusief moeilijk te kristalliseren celoppervlakreceptoren en andere membraaneiwitten, flexibele eiwitten, en veel complexe menselijke eiwitten, " zei Brookhaven Lab-wetenschapper Qun Liu, de corresponderende auteur van het onderzoek, die op 3 mei werd gepubliceerd, 2019, in IUCrJ , een tijdschrift van de International Union of Crystallography.
Eiwitstructuren ontcijferen
Eiwitkristallografie is sinds 1958 een dominante methode voor het oplossen van eiwitstructuren, na verloop van tijd verbeteren naarmate röntgenbronnen krachtiger zijn geworden, waardoor nauwkeurigere structuurbepalingen mogelijk zijn. Om een eiwitstructuur te bepalen, wetenschappers meten hoe röntgenstralen zoals die gegenereerd bij NSLS-II diffract, of stuiteren, de atomen in een geordend kristalrooster bestaande uit vele kopieën van hetzelfde eiwitmolecuul, allemaal op dezelfde manier gerangschikt. Het diffractiepatroon geeft informatie over waar de atomen zich bevinden. Maar het is niet voldoende.
"Alleen de amplitudes van afgebogen röntgenstraling 'golven' worden geregistreerd op de detector, maar niet hun fasen (de timing tussen golven), " zei Liu. "Beide zijn nodig om een 3D-structuur te reconstrueren. Dit is het zogenaamde kristallografische faseprobleem."
Kristallografen hebben dit probleem opgelost door fasegegevens te verzamelen van een ander soort verstrooiing, bekend als abnormale verstrooiing. Afwijkende verstrooiing treedt op wanneer atomen zwaarder dan de belangrijkste koolstofcomponenten van een eiwit, waterstof, en stikstof absorbeert en zendt een deel van de röntgenstralen opnieuw uit. Dit gebeurt wanneer de röntgenenergie dicht bij de energie komt die die zware atomen graag absorberen. Hiervoor brengen wetenschappers soms kunstmatig zware atomen zoals selenium of platina in het eiwit in. Maar zwavelatomen, die van nature voorkomen in eiwitmoleculen, kan ook dergelijke signalen produceren, zij het zwakker. Ook al zijn deze afwijkende signalen zwak, een groot kristal heeft meestal genoeg kopieën van het eiwit met voldoende zwavelatomen om ze meetbaar te maken. Dat geeft wetenschappers de fase-informatie die nodig is om de locatie van de zwavelatomen te bepalen en de diffractiepatronen te vertalen naar een volledige 3D-structuur.
"Als je eenmaal de zwavelposities kent, je kunt de fasen voor de andere eiwitatomen berekenen omdat de relatie tussen de zwavel en de andere atomen vast ligt, " zei Liu.
Maar kleine kristallen, per definitie, niet zoveel exemplaren van het eiwit van interesse hebben. Dus in plaats van te zoeken naar diffractie- en fase-informatie van herhaalde kopieën van een eiwit in een enkel groot kristal, het Brookhaven/Columbia-team ontwikkelde een manier om metingen te doen van veel kleine kristallen, en verzamel vervolgens de collectieve gegevens.
kleine kristallen, grote resultaten
Om de kleine kristallen te hanteren, het team ontwikkelde monsterrasters met patronen van micro-putjes. Na het gieten van oplosmiddel met de microkristallen over deze goed gemonteerde roosters, de wetenschappers verwijderden het oplosmiddel en bevroor de kristallen die op de roosters vastzaten.
"We hebben nog een uitdaging, Hoewel, omdat we niet kunnen zien waar de kleine kristallen zijn op ons raster, "zei Liu. "Om erachter te komen, we gebruikten microdiffractie bij NSLS-II's Frontier Microfocusing Macromolecular Crystallography (FMX) bundellijn om het hele raster te onderzoeken. Lijn voor lijn scannen, we kunnen vinden waar die kristallen zijn verborgen."
Zoals Martin Fuchs, de leidende beamline-wetenschapper bij FMX, uitgelegd, "De FMX-bundellijn kan de volledige intensiteit van de röntgenbundel focussen tot een grootte van één micron, of miljoenste van een meter. We kunnen de bundelgrootte nauwkeurig regelen om deze af te stemmen op de grootte van de kristallen - vijf micron in het geval van het huidige experiment. Deze mogelijkheden zijn cruciaal voor het verkrijgen van het beste signaal, " hij zei.
Wuxian Shi, een andere FMX beamline-wetenschapper, merkte op dat "de gegevens die in het rasteronderzoek zijn verzameld informatie bevatten over de locatie van de kristallen. we kunnen ook zien hoe goed elk kristal buigt, waardoor we alleen de beste kristallen kunnen kiezen voor het verzamelen van gegevens."
De wetenschappers waren vervolgens in staat om de monsterhouder te manoeuvreren om elk in kaart gebracht microkristal van belang terug in het midden van de nauwkeurige röntgenstraal te plaatsen voor gegevensverzameling.
Ze gebruikten de laagste beschikbare energie bij de bundellijn - afgestemd om de absorptie-energie van zwavelatomen zo dicht mogelijk te benaderen - en verzamelden afwijkende verstrooiingsgegevens.
"De meeste kristallografische bundellijnen konden de zwavelabsorptierand niet bereiken voor geoptimaliseerde afwijkende signalen, " zei co-auteur Wayne Hendrickson van Columbia University. "Gelukkig, NSLS-II is een toonaangevende synchrotron-lichtbron die heldere röntgenstralen levert die een breed spectrum van röntgenstralingsenergie bestrijken. En hoewel ons energieniveau iets boven de ideale absorptie-energie voor zwavel lag, het genereerde de afwijkende signalen die we nodig hadden."
Maar de wetenschappers hadden nog wat werk te doen om die belangrijke signalen te extraheren en de gegevens uit vele kleine kristallen te verzamelen.
"We krijgen in feite duizenden stukjes data, " zei Liu. "We gebruikten ongeveer 1400 microkristallen, elk met een eigen dataset. We moeten alle gegevens van die microkristallen samenvoegen."
They also had to weed out data from crystals that were damaged by the intense x-rays or had slight variations in atomic arrangements.
"A single microcrystal does not diffract x-rays sufficiently for structure solution prior to being damaged by the x-rays, " said Sean McSweeney, deputy photon division director and program manager of the Structural Biology Program at NSLS-II. "This is particularly true with crystals of only a few microns, the size of about a bacterial cell. We needed a way to account for that damage and crystal structure variability so it wouldn't skew our results."
They accomplished these goals with a sophisticated multi-step workflow process that sifted through the data, discarded outliers that might have been caused by radiation damage or incompatible crystals, and ultimately extracted the anomalous scattering signals.
"This is a critical step, " said Liu. "We developed a computing procedure to assure that only compatible data were merged in a way to align the individual microcrystals from diffraction patterns. That gave us the required signal-to-noise ratios for structure determination."
Applying the technique
This technique can be used to determine the structure of any protein that has proven hard to crystallize to a large size. These include cell-surface receptors that allow cells of advanced lifeforms such as animals and plants to sense and respond to the environment around them by releasing hormones, transmitting nerve signals, or secreting compounds associated with cell growth and immunity.
"To adapt to the environment through evolution, these proteins are malleable and have lots of non-uniform modifications, " said Liu. "It's hard to get a lot of repeat copies in a crystal because they don't pack well."
In mensen, receptors are common targets for drugs, so having knowledge of their varied structures could help guide the development of new, more targeted pharmaceuticals.
But the technique is not restricted to just small crystals.
"The method we developed can handle small protein crystals, but it can also be used for any size protein crystals, any time you need to combine data from more than one sample, ' zei Liu.
 Eindelijk synthetisch canataxpropellane:een van de meest complexe producten van de natuur reproduceren
Eindelijk synthetisch canataxpropellane:een van de meest complexe producten van de natuur reproduceren Na 150 jaar, een doorbraak in het begrijpen van de omzetting van CO2 naar elektrobrandstoffen
Na 150 jaar, een doorbraak in het begrijpen van de omzetting van CO2 naar elektrobrandstoffen Onderzoekers ontdekken verborgen ontijzingsrisico's die de gezondheid van de brug beïnvloeden
Onderzoekers ontdekken verborgen ontijzingsrisico's die de gezondheid van de brug beïnvloeden Hoe MV naar PPM
Hoe MV naar PPM Wetenschappers richten zich op kankerbehandelingen met CRISPR
Wetenschappers richten zich op kankerbehandelingen met CRISPR
 Wat zijn de effecten van niet-biologisch afbreekbaar afval?
Wat zijn de effecten van niet-biologisch afbreekbaar afval?  Satellietgegevens helpen bij het detecteren en monitoren van bosbranden in Nepal
Satellietgegevens helpen bij het detecteren en monitoren van bosbranden in Nepal Verborgen olieramp:nieuwe studie spreekt de beweringen van eigenaren tegen
Verborgen olieramp:nieuwe studie spreekt de beweringen van eigenaren tegen Tienduizenden opgeroepen om te evacueren nu zware regen Japan treft
Tienduizenden opgeroepen om te evacueren nu zware regen Japan treft Ophoping van plastic in diepzee door troebelheidsstromen:NW Zuid-Chinese zee
Ophoping van plastic in diepzee door troebelheidsstromen:NW Zuid-Chinese zee
Hoofdlijnen
- Onderzoekers rapporteren een fundamentele spiersnelheidslimiet
- De juiste manier om DNA te repareren
- Onderzoekswetenschappers ontdekken nieuwe productieroute voor SOS-signalen van planten
- Nieuwe benadering van onderzoek naar vogelnavigatie leidt tot ontwikkeling van besluitvormingsmodel voor dieren
- Wat zijn de spoelen van DNA in de kern?
- Hoe verschilt DNA & RNA?
- Kunnen genetisch gemodificeerde muggen malaria uitroeien?
- De vergeten wetenschapper die de weg vrijmaakte voor de ontdekking van de DNA-structuur
- In welke levensfase komt mitose sneller voor?
- Onderzoekers komen op de golflengte van de consument met InSb-technologie
- Atomen in grammen omrekenen met een rekenmachine

- Expert:het gebruik van koolstof is de sleutel tot het koolstofarm maken van de economie

- Zout helpt eiwitten om verder te komen
- Kristallografie biedt blauwdrukken voor gevechtsplannen voor het aanvallen van ziekteverwekkende bacteriën
 Wetenschappers bereiken allereerste versnelling van elektronen in plasmagolven
Wetenschappers bereiken allereerste versnelling van elektronen in plasmagolven Raket verlicht de hemel terwijl hij satellieten uit Californië vervoert
Raket verlicht de hemel terwijl hij satellieten uit Californië vervoert Vanderbilt ingenieur de eerste die dynamische manipulatie met laag vermogen van enkele kwantumobjecten op nanoschaal introduceert
Vanderbilt ingenieur de eerste die dynamische manipulatie met laag vermogen van enkele kwantumobjecten op nanoschaal introduceert Hoe bergen koolstof vasthouden
Hoe bergen koolstof vasthouden Huawei lanceert nieuwe tablet in vlaggenschip telefoon hiaat
Huawei lanceert nieuwe tablet in vlaggenschip telefoon hiaat NASA's Europa-flyby-missie gaat naar ontwerpfase
NASA's Europa-flyby-missie gaat naar ontwerpfase Eigenschappen van water op nanoschaal zullen helpen bij het ontwerpen van innovatieve technologieën
Eigenschappen van water op nanoschaal zullen helpen bij het ontwerpen van innovatieve technologieën Platentektoniek niet nodig om leven in stand te houden
Platentektoniek niet nodig om leven in stand te houden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

