Wetenschap
Modellering van biomimetische collageen-ligand-interacties om intrafibrillaire mineralisatie te begrijpen
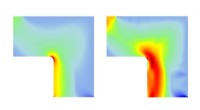
Volledige atomistische moleculaire dynamica-simulatie van een HPAA-collageenstructuur met hoge resolutie, geconstrueerd om het effect van de aanwezigheid van grote polyelektrolytmoleculen langs het oppervlak van collageenfibrillen op de beweging en infiltratie van ionen in een biomimetisch model te onderzoeken. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav9075.
Levende organismen vormen biologische mineralen tijdens biomineralisatie, waar anorganische elementen zich selectief kunnen afzetten op specifieke organische macromoleculen onder nauwkeurige controle. Het proces kan worden onderverdeeld in biocalcificatie of biosilicificatie op basis van de anorganische component, met collageen dat als universele sjabloon wordt gebruikt. Tijdens intrafibrillaire mineralisatie, collageenmatrices die bestemd zijn voor mineralisatie bij gewervelde dieren bevatten aan het oppervlak gebonden matrixeiwitten. Het begrijpen van de complexe mechanismen van intrafibrillaire mineralisatie om hard collageen weefsel zoals bot en dentine te vormen, is van groot belang in de biomechanica, met tientallen jaren van onderzoeken die zijn uitgevoerd om het proces in het laboratorium na te bootsen of te modelleren. In een recente studie, nu gepubliceerd in wetenschappelijke vooruitgang , Q. Song en medewerkers van de interdisciplinaire afdelingen Biologie, Toegepaste fysica, Materiaalkunde en techniek, Biomedische Wetenschappen en Tandheelkunde, in China, de VS en Italië, hebben een biomechanisch model ontwikkeld om de interacties tussen collageen en liganden te onderzoeken die bijdragen aan intrafibrillaire mineralisatie.
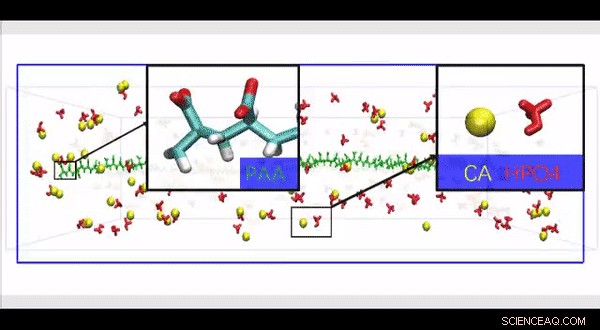
In de studie, ze gebruikten negatief geladen, polycarbonzuur met hoog molecuulgewicht, verknoopt met gereconstitueerd collageen, om het biomimetische model te creëren. Ze voerden cryogene elektronenmicroscopie en moleculaire dynamica-simulaties uit, om aan te tonen dat ketenachtige aggregaten gevormd na verknoping aan collageen, langs het fibrillaire oppervlak om fibrillaire mineralisatie te implementeren. Ze merkten op dat de negatief geladen, gemineraliseerde steigers stelden hen in staat een hogere kwaliteit te bereiken met betere biomechanische eigenschappen, vergeleken met mineralisatie op ongewijzigde steigers. Het werk aan collageen-ligand-interactie gaf de wetenschappers inzicht in de oorsprong van heterogeen gemineraliseerde weefsels en verduidelijkte ook de mogelijke oorzaken van ectopische calcificatie (ongepaste biomineralisatie) in niet-gemineraliseerde lichaamsweefsels.
Biomineralen die in de natuur voorkomen, bevatten van nature calcium om calciumfosfaat (CaP) en octacalciumfosfaat te vormen als voorbeelden. CaP-bevattende biomineralen vormen specifiek vertebrale harde bindweefsels, terwijl calciumcarbonaat het ongewervelde skelet vormt. Collageenfibrillen kunnen worden gebruikt als mineralisatiesjablonen dankzij kanalen op nanoschaal in hun fibrillaire structuren om nano-gemanipuleerde hybriden te vormen met gecombineerde sterkte en veerkracht. Echter, het proces kan niet worden bereikt door eenvoudig collageenmatrices onder te dompelen in een oververzadigde oplossing van minerale ionen, in plaats daarvan is het gebruik van nucleatieremmers vereist om ionassociatiecomplexen te stabiliseren en hun kristallisatie buiten de fibrillen te voorkomen. Als resultaat, in het laatste decennium, wetenschappers hebben verschillende in vitro modellen voorgesteld om de mechanismen van intrafibrillaire mineralisatie te begrijpen. In de voorgaande studiemodellen remmers van kristalkiemvorming werden opgenomen in het mineralisatiemedium en niet gebonden aan de collageenfibrillen, vertrekkend van het typische scenario dat zich voordeed in biologische systemen. In het huidige studiemodel is Song et al. daarom konden de remmers de collageenfibrillen binden voor adequate biomimicry.
Karakterisering van PAA-collageen. (A) Infraroodspectra van PAA-collageensponzen. Spectra werden genormaliseerd langs de collageenamide A-piek (~ 3300 cm-1, NH-rek gekoppeld aan waterstofbrug) Vergeleken met het spectrum van bloot collageen, de spectra van HPAA-gebonden collageen (HPAA-collageen) en LPAA-gebonden collageen (LPAA-collageen) sponzen tonen verhogingen in de amide B, L, ik, en III pieken. (B) Vast oppervlak -potentieel van HPAA-collageen, LPAA-collageen, en kaal collageen. Verknoping van PAA aan het collageenmolecuul resulteerde in significant lagere ζ-potentialen van −17,17 ± 1,98 mV voor HPAA-collageen, −15,19 ± 1,22 mV voor LPAA-collageen, en -3,04 ± 0,37 mV voor bloot collageen. (C en D) Vergelijking van carboxyl (C) en aminegroepen (D) tussen PAA-collageen en kaal collageen. Na anionische modificatie, de hoeveelheden carboxylgroep (in mM/g collageen) in het HPAA-collageen (1,907 ± 0,084) en LPAA-collageen (1,807 ± 0,035) waren significant hoger dan die van het kale collageen (0,460 ± 0,017). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav9075. 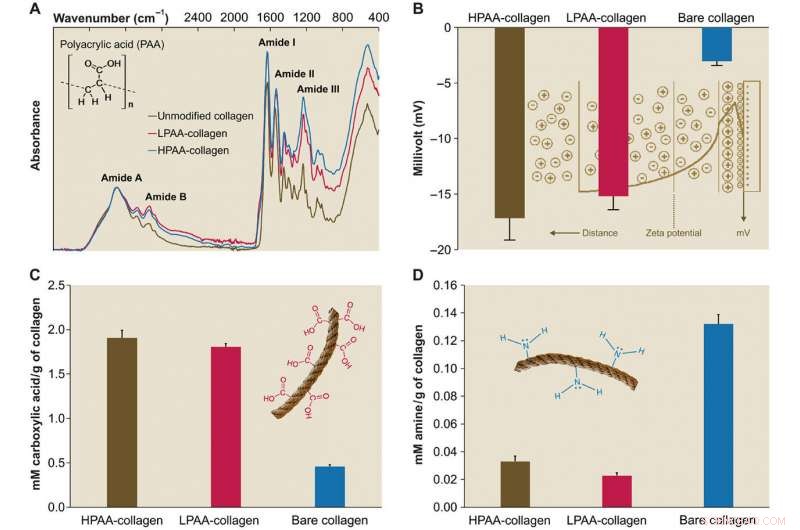
Aangezien fysiologische niet-collageneuze eiwitten moeilijk te extraheren en functioneel complex zijn voor gebruik in biomimetische mineralisatiestudies, Song et al. gebruikten anionische polyelektrolyten als nucleatieremmers in hun model van intrafibrillaire mineralisatie. Anionische polyelektrolyten kunnen de sterk anionische en intrinsiek ongeordende eiwitconformatie nabootsen die wordt aangetroffen in niet-collageenachtige eiwitten. In het voorgestelde model is de polyelektrolyt-kiemvormingsremmers bonden aan het matrixeiwitvrije gereconstitueerde collageen als modellen van intrafibrillaire mineralisatie. Song et al. simuleerde eerst de moleculaire dynamica om aan te tonen dat een polyelektrolyt zoals polyacrylzuur (PAA) calcium- en waterstoffosfaationcomplexen kon reserveren in ketenachtige aggregaten langs het oppervlak van het macromolecuul na introductie in een oververzadigd CaP-mineralisatiemedium.
Op basis van de gesimuleerde moleculaire dynamica, Song et al. een testhypothese ontwikkeld dat een nucleatieremmer gebonden aan het oppervlak van collageenfibrillen CaP-mineralisatieprecursoren nabij de fibrillen zou kunnen stabiliseren, voor efficiënte intrafibrillaire mineralisatie. Om de hypothese te testen, ze gebruikten controles met een ongebonden versie van dezelfde polyelektrolyt die in plaats daarvan werd gebruikt om de CaP-precursoren te stabiliseren die in het mineralisatiemedium waren opgenomen.

Simulatie van de late fase van intrafibrillaire mineralisatie van HPAA-collageen. 3D-weergave van de late fase van intrafibrillaire mineralisatie van HPAA-collageen die accumulatie van prenucleatieclusteraggregaten (geel) langs het fibriloppervlak laat zien; intrafibrillaire mineralen zijn afgebeeld in oranje. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav9075.
De wetenschappers gebruikten polyacrylzuur met een hoog molecuulgewicht - PAA (HPAA) om osteopontine te simuleren en PAA (LPAA) met een laag molecuulgewicht om osteocalcine te simuleren. Ze verknoopten de polyanionische elektrolyten chemisch om type I collageenfibrillen of -sponzen te reconstrueren met behulp van organische verbindingen en onderzochten de polymeerconstitutie met behulp van Fourier-transformatie-infraroodspectroscopie (FTIR). Song et al. gebruikte transmissie-elektronenmicroscopie (TEM) om PAA-gebonden collageenfibrillen te observeren die rood gekleurd waren en registreerden ze als elektronendichte filamenteuze aggregaten op het fibriloppervlak. Vervolgens gebruikten ze high-performance vloeistofchromatografie om de kenmerken van binding / afgifte van PAA-collageensponzen te onderzoeken.
Simuleren van de moleculaire dynamica van biomineralisatie
Om de verschillende fasen van intrafibrillaire mineralisatie van HPAA-gebonden collageen (HPAA-collageen) te begrijpen, de wetenschappers maakten films met behulp van de elektronentomografiegegevens van de verschillende fasen van biomineralisatie. Ze simuleerden de (1) vroege fase - om de accumulatie van prenucleatieclusteraggregaten rond de niet-gemineraliseerde collageenvezel te tonen, (2) middenfase - om gedeeltelijke intrafibrillaire mineralisatie aan te tonen en (3) late fase - om zware intrafibrillaire mineralisatie van de HPAA-collageenfibrillen aan te tonen. Ze toonden aan dat LPAA-collageen geen intrafibrillaire mineralisatie induceerde in vergelijking met HPAA in de studie, en nam daarom de polymeren niet op in de daaropvolgende experimenten.

Moleculaire dynamische simulaties. (A) Profiel van kale collageen microfibrillaire structuren met watermoleculen in de intrafibrillaire ruimtes. Blauwe linten, collageen drievoudige helices; rode stippen, water moleculen. (B) zijaanzicht van kale collageen microfibrillen. De blauwe lijnen beschrijven de 67 nm lange simulatiebox. (C en D) Beweging van Ca2+ (gele bollen), HPO42− (rode samenstellingen), en geassembleerde CaP-mineralisatieprecursoren (geel-rode assemblages) over de collageenmicrofibrillen met de HPAA (groene keten) gebonden aan de LYS1099-aminozuren van de collageenmoleculen. (E) Boven:simulatie van de beweging van verschillende ionen over de HPAA-collageen microfibrillaire structuren op aangewezen simulatietijden. Blauwe bollen, paarse bollen, gele bollen, rode montage, geel-rode assemblages, en groene ketenstructuur vertegenwoordigen Na+ -ionen, Cl− ionen, Ca2+ ionen, HPO42−-ionen, CaP-mineralisatieprecursoren, en HPAA, respectievelijk. Onder:Dynamische veranderingen in het aantal Ca2+ (zwarte lijn), HPO42− (rode lijn), Na+ (groene lijn), en Cl− (blauwe lijn) in de intrafibrillaire en extrafibrillaire gebieden langs de a-asgrens bij 0, 30, 50, en 70 ns. (F) Beweging van Ca2+, HPO42−, en geassembleerde CaP-mineralisatieprecursoren over de kale collageenmicrofibrillen met ongebonden HPAA in het extrafibrillaire gebied (controle). (G) Vergelijking van de verdeling van verschillende ionen binnen het intrafibrillaire gebied in de collageengebonden HPAA en de ongebonden HPAA-mineralisatiemodellen. (H) Vergelijking van de gemiddelde kwadratische afwijking van collageenmoleculen in de collageengebonden HPAA- en de ongebonden HPAA-modellen. (I) vergelijking van het voor oplosmiddel toegankelijke oppervlak (SASA) van de collageenmoleculen tussen de twee modellen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav9075.
Song et al. daarna gebruikte moleculaire dynamische simulaties van het mineralisatieproces om de structuur-naar-functie relatie te begrijpen en valideerde het vermogen van collageengebonden HPAA om CaP-mineralisatieprecursoren te aggregeren. Voor deze, ze gebruikten een volledig atomistisch model van het gehydrateerde HPAA-collageenfibrilcomplex. In het eenheidsmodel ze simuleerden Ca 2+ en HPO 4 2- ionen en verzamelde CaP-mineralisatieprecursoren om zich rond de collageengebonden HPAA te vormen. Het werk onthulde de verdeling van natriumionen, chloride, calcium en HPO 4 2- ionen langs de as van de eenheidsmodelgrens.
De ultrastructuur onderzoeken
Voor ultrastructurele onderzoeken van het biomimetische model, Song et al. gebruikte nano-indentatie om de Young's moduli van gemineraliseerde en niet-gemineraliseerde collageenfibrillen te beoordelen met atomaire krachtmicroscopie (AFM). De waarden waren vergelijkbaar met die eerder gerapporteerd voor gemineraliseerde en niet-gemineraliseerde fibrillen, berekend met behulp van nano-inspringing. De wetenschappers gebruikten röntgendiffractiespectroscopie om de aanwezigheid van apatiet op de gemineraliseerde sponzen te identificeren. De studie toonde aan dat HPAA-collageen gemineraliseerd in CaP-oplossing gedurende zeven dagen een hoger mineraalgehalte had dan kaal collageen. Wanneer Song et al. berekende de verhouding apatiet/collageen in de spectroscopische profielen, de HPAA-collageensponzen duidden op hogere niveaus van mineralisatie.
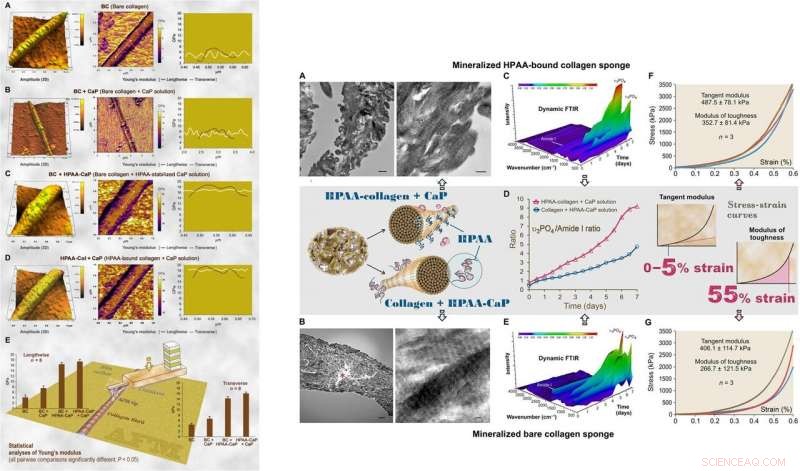
:LINKS:AFM van de 3D-oppervlaktetopografie en elasticiteitsmodulus (Young's modulus) mapping van representatieve luchtgedroogde, gemineraliseerd bloot collageen en HPAA-collageenfibrillen. (A) Kale collageenfibrillen (BC) hadden een bijna normale verdeling van Young's modulus transversaal over de fibril. (B) Kale collageen gemineraliseerd in CaP-oplossing zonder kiemvormingsremmer (BC + CaP). (C) Kale collageen gemineraliseerd met HPAA-CaP-oplossing (BC + HPAA-CaP). (D) HPAA-collageen gemineraliseerd met CaP-oplossing zonder kiemvormingsremmer (HPAA-Col + CaP). (E) statistische analyses van de Young's modulus van collageenfibril in de lengte- en dwarsrichtingen (n =8). RECHTS:Karakterisering van gemineraliseerde HPAA-collageensponzen en kale collageensponzen. (A) TEM van gemineraliseerde HPAA-collageen sponzen. (B) TEM van gemineraliseerde kale collageensponzen. (C) Dynamische verzwakte totale reflectie (ATR) -FTIR toont progressieve mineralisatie van een HPAA-collageenspons met tussenpozen van 12 uur over een periode van 7 dagen. (D) Veranderingen in de verhouding apatiet υ3PO4/collageenamide I van gemineraliseerde anionische collageensponzen en ongemodificeerde collageensponzen. E) Dynamische ATR-FTIR toont de voortgang van de mineralisatie van een kale collageenspons in HPAA-CaP-oplossing. (F) Stress-strain-respons van gemineraliseerde HPAA-collageensponzen voor het bepalen van de tangensmodulus en de taaiheidsmodulus (inzet, middelste rij). (G) Stress-rekreactie van gemineraliseerde kale collageensponzen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aav9075.
De modulus van taaiheid, die typisch de energie per volume-eenheid aangeeft die een materiaal kan absorberen voordat het scheurt, was ook significant hoger voor HPAA-collageensponzen, wat wijst op breukweerstand van het materiaal. Dergelijke kenmerken verklaren de hoge veerkracht van biogemineraliseerde op collageen gebaseerde weefsels die botmicroarchitectuur nabootsen om de boteigenschappen van taaiheid en sterkte in regeneratieve engineering te combineren. Song et al. toegeschreven aan de waargenomen eigenschappen van cohesie/adhesie aan HPAA-verknoping, waardoor de collageen/mineraalcomposiet kon worden gemaakt, vergelijkbaar met het verknoopte osteopontine dat wordt aangetroffen in botarchitectuur.
Toepassingen van de nieuwe biocompatibele constructies
Aangezien de biocompatibiliteit van nieuwe materialen een belangrijk kenmerk is in materiaalwetenschap en bio-engineering, Song et al. geverifieerd gunstige cel-materiaal interacties op HPAA-verknoopt collageen met behulp van stamcel levensvatbaarheid en proliferatie tijdens in-lab botregeneratie celcultuur. Toen de wetenschappers mitochondriale dehydrogenase- en apoptose-assays uitvoerden op menselijke mesenchymale stamcellen, ze zagen geen significante verschillen tussen het niet-gemineraliseerde HPAA-collageen en kale collageensponzen. Vanwege hun compatibiliteit met menselijke osteoblastachtige cellen, dergelijke materialen kunnen worden gebruikt als biocompatibele coatings voor chirurgische implantaten.
Op deze manier, Song et al. demonstreerde een biomechanisch model van intrafibrillaire mineralisatieverbetering met behulp van collageen-ligand-interacties om de plaatsspecifieke mechanismen te begrijpen. Dit model van collageen-ligand-interacties kan ook licht werpen op de mogelijke oorzaken van ectopische mineralisatie, wat op dit moment interessant is. In het perspectief van Song et al., intrafibrillaire mineralisatie via collageen-ligand-interacties kan mineralen consistenter infiltreren in bulkcollageenmatrices voor toepassingen in regeneratieve geneeskunde. De resultaten zullen helpen de biomechanische eigenschappen te begrijpen, terwijl gebreken worden verminderd om de biomimetische kenmerken van een gemineraliseerde collageenmatrix in tissue engineering te vergroten.
© 2019 Wetenschap X Netwerk
 Wortelbacterie om Alzheimer te bestrijden:Rhizolutin dissocieert bèta- en tau-aggregaten
Wortelbacterie om Alzheimer te bestrijden:Rhizolutin dissocieert bèta- en tau-aggregaten Surrey bouwt AI om chemische verbindingen tegen veroudering te vinden
Surrey bouwt AI om chemische verbindingen tegen veroudering te vinden Schone technologie om chitosan met laag molecuulgewicht te maken
Schone technologie om chitosan met laag molecuulgewicht te maken Onderzoekers ontwikkelen celzuigtechnologie
Onderzoekers ontwikkelen celzuigtechnologie Een slimme chemo-enzymatische methode detecteert en verwijdert gevaarlijke fenolen
Een slimme chemo-enzymatische methode detecteert en verwijdert gevaarlijke fenolen
 Koolstofstudie in Amazonewoud onthult inheemse gebieden, beschermde gebieden belegerd, toch de beste klimaatoplossing blijven
Koolstofstudie in Amazonewoud onthult inheemse gebieden, beschermde gebieden belegerd, toch de beste klimaatoplossing blijven Leven konijnen in gaten in de grond?
Leven konijnen in gaten in de grond?  Meer gedetailleerde gegevens over thermische omstandigheden van Arctische grond
Meer gedetailleerde gegevens over thermische omstandigheden van Arctische grond Hoe veroorzaken fabrieken luchtvervuiling?
Hoe veroorzaken fabrieken luchtvervuiling?  Over de dieren van Antarctica
Over de dieren van Antarctica
Hoofdlijnen
- Glimlachende menselijke gezichten zijn aantrekkelijk voor honden - dankzij oxytocine
- Poema's die in de buurt van menselijke ontwikkeling leven, verbruiken meer energie
- Verschil tussen koppelingstoewijzing en chromosoommapping
- Welke soorten cellen zijn bacteriën?
- Gescheiden sinds de dinosauriërs, bamboe-etende lemuren, panda's delen gemeenschappelijke darmmicroben
- Hoe jaloezie werkt
- Difference Between Mutation & Genetic Drift
- Kweek vers voedsel in uw huis - verticaal
- Kan iemand zich herinneren dat hij geboren is?
 Radiopulsaties gedetecteerd van de gammastraal-milliseconde pulsar PSR J2039-5617
Radiopulsaties gedetecteerd van de gammastraal-milliseconde pulsar PSR J2039-5617 Zonnepanelen ter grootte van een vlo ingebed in kleding kunnen een mobiele telefoon opladen
Zonnepanelen ter grootte van een vlo ingebed in kleding kunnen een mobiele telefoon opladen Dubbelster bestaande uit twee bruine dwergen ontdekt door microlensing
Dubbelster bestaande uit twee bruine dwergen ontdekt door microlensing Kunstmatige intelligentie gebruiken om leemten in oude teksten op te vullen
Kunstmatige intelligentie gebruiken om leemten in oude teksten op te vullen Onderzoekers ontdekken drielaagse voorhoede van coronale massa-ejecties van de zon
Onderzoekers ontdekken drielaagse voorhoede van coronale massa-ejecties van de zon PSI-beeldvorming helpt bij raketlanceringen
PSI-beeldvorming helpt bij raketlanceringen DNA-origami veerkrachtiger dan eerder werd begrepen
DNA-origami veerkrachtiger dan eerder werd begrepen 5 manieren waarop de extreme Arctische hittegolf een verontrustend patroon volgt
5 manieren waarop de extreme Arctische hittegolf een verontrustend patroon volgt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com