
Wetenschap
Het labelen van eiwitten met ubiquitine effent een nieuwe weg naar onderzoek naar celregulatie
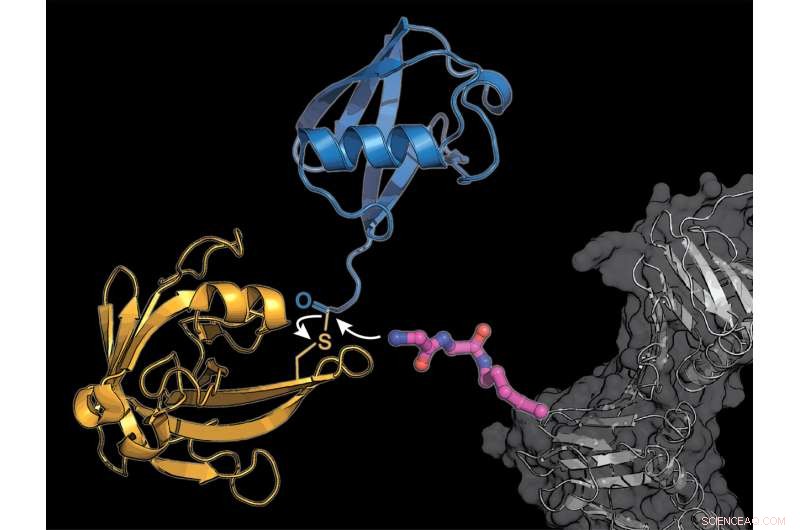
De onderzoekers rustten een cellulair eiwit (grijs) uit met een gemodificeerde lysine-aminozuurbouwsteen (roze), waaraan het bacteriële enzym sortase (geel) een ubiquitinemolecuul (blauw) overdraagt. Krediet:K. Lang / TUM
Menselijke cellen hebben een geavanceerd regulerend systeem dat bestaat uit het labelen van eiwitten met het kleine molecuul ubiquitine. In een eerste, een team van de Technische Universiteit van München (TUM) is erin geslaagd eiwitten met ubiquitine gericht te markeren in reageerbuisjes en in levende cellen. De procedure opent de deur naar het verkennen van de innerlijke werking van dit vitale regelgevende systeem.
Planten, schimmels, dieren en mensen brengen het eiwit ubiquitine tot expressie. Het bestaat uit een reeks van 76 aminozuren, waardoor het een relatief klein biomolecuul is. Maar de invloed ervan is verstrekkend:het type, positie en aantal ubiquitine-moleculen gebonden aan eiwitten bepalen hun stabiliteit, functie, en locatie in de cel.
"Vrijwel elk proces in de cel wordt direct of indirect beïnvloed door ubiquitine. Dat is de reden waarom storingen van dit labelingsmechanisme worden geassocieerd met de ontwikkeling en progressie van kanker en vele andere ernstige ziekten, " legt Kathrin Lang uit, Hoogleraar synthetische biochemie aan de Technische Universiteit van München.
De ontdekking van de belangrijke rol die dit cellulaire regelsysteem speelt bij de gecontroleerde afbraak van eiwitten werd erkend met de Nobelprijs voor de Scheikunde van 2004. Maar, in veel gevallen blijven de details van hoe ubiquitine-modificaties de functie van cellen beïnvloeden, onduidelijk. Het team van Kathrin Lang heeft nu een methode ontwikkeld om ubiquitine-labels aan gerichte eiwitten te bevestigen - een sleutel tot het verkennen van het systeem.
Een bacterieel enzym creëert nieuwe verbindingen
Het team van Lang gebruikt twee trucs om het gecompliceerde natuurlijke systeem te omzeilen:ze bevatten een nieuw gemodificeerd aminozuur, waaraan het van bacteriën afgeleide enzym sortase ubiquitine of een ubiquitine-vergelijkbaar molecuul kan hechten.

Eerste auteur Maximilian Fottner en prof. Kathrin Lang in hun laboratorium. Krediet:Andreas Battenberg / TUM
"De grootste uitdaging was om de verschillende stappen - de opname van het onnatuurlijke aminozuur in een doeleiwit en de overdracht van ubiquitine door het enzym sortase - zo op elkaar af te stemmen dat ze niet alleen in de reageerbuis maar ook in het leven werken. cellen, " herinnert Maximilian Fottner zich, de hoofdauteur van de studie.
Ondertussen, de onderzoekers van de Technische Universiteit van München hebben hun nieuwe methode geoptimaliseerd en gepatenteerd voor veel verschillende cellulaire eiwitten. "We zijn al samenwerkingen aangegaan met artsen en celbiologen die nu met ons willen samenwerken om de effecten van ubiquitinemarkers op de ontwikkeling van kanker en neurodegeneratieve ziekten zoals Parkinson op moleculair niveau te bestuderen, " zegt prof. Lang.
 De duikklokspin nabootsen om de omzetting van koolstof in brandstoffen te verbeteren
De duikklokspin nabootsen om de omzetting van koolstof in brandstoffen te verbeteren Wetenschappers creëren nieuw materiaal voor elektronica van de toekomst
Wetenschappers creëren nieuw materiaal voor elektronica van de toekomst Hoe maak je een Atoomreplica van Uranium voor School
Hoe maak je een Atoomreplica van Uranium voor School Hoe Mollen Geproduceerde Producten Berekenen
Hoe Mollen Geproduceerde Producten Berekenen  Mysterie van de biosynthese van immunosuppressiva eindelijk ontgrendeld
Mysterie van de biosynthese van immunosuppressiva eindelijk ontgrendeld
 COVID-19-crisis veroorzaakt 17% daling van de wereldwijde CO2-uitstoot:studie
COVID-19-crisis veroorzaakt 17% daling van de wereldwijde CO2-uitstoot:studie NASA kijkt naar zware regenmaker in Hurricane Lane
NASA kijkt naar zware regenmaker in Hurricane Lane Studie bevestigt dat klimaatverandering de neerslag en grootte van orkaan Florence beïnvloedde
Studie bevestigt dat klimaatverandering de neerslag en grootte van orkaan Florence beïnvloedde Klimaatverandering zorgt voor sterke toename gletsjermeren
Klimaatverandering zorgt voor sterke toename gletsjermeren NASA-satellietbeelden vinden dat Typhoon Halong lijkt op een bokshandschoen
NASA-satellietbeelden vinden dat Typhoon Halong lijkt op een bokshandschoen
Hoofdlijnen
- Onderdelen van sperma
- Wetenschappers ontdekken een eeuwenoud geval van identiteitsverwisseling in de Chesapeake Bay
- Orkaan verscheurde het gerenommeerde onderzoekscentrum van Monkey Island
- Hoe zijn bacteriën en plantencellen gelijk?
- Hoe een tRNA-reeks te krijgen van een DNA-reeks
- Officiële vishandel onderschat wereldwijde vangsten enorm
- Wat doet ons gapen?
- EU-parlement stemt voor verbod controversiële onkruidverdelger in 2022
- Zelfs wilde zoogdieren hebben regionale dialecten
- Wetenschappers geven een glimp met hoge resolutie van de enzymstructuur
- De stikstofmonoxide-signaleringsroute volgen
- Warme melk maakt je slaperig - peptiden kunnen verklaren waarom

- Suikers synthetiseren:scheikundigen ontwikkelen methode om de opbouw van koolhydraten te vereenvoudigen
- Hoe goud biobrandstofafval kan recyclen tot nuttig additief

 Onderzoekers beslechten ruzie over mobiliteit van flexibele filamenten (met video)
Onderzoekers beslechten ruzie over mobiliteit van flexibele filamenten (met video) Frans telecombedrijf Orange veroordeeld voor zelfmoorden
Frans telecombedrijf Orange veroordeeld voor zelfmoorden Technologie in de klas kan de primaire wiskunde verbeteren
Technologie in de klas kan de primaire wiskunde verbeteren Chemische processen in Forensics
Chemische processen in Forensics Koude lucht stijgt op - wat dat betekent voor het klimaat op aarde
Koude lucht stijgt op - wat dat betekent voor het klimaat op aarde Wetenschapper bestudeert hoe ze kankermedicijnen kunnen omzetten in hun eigen toedieningssystemen
Wetenschapper bestudeert hoe ze kankermedicijnen kunnen omzetten in hun eigen toedieningssystemen Als een visnet, nanonet stort in om medicijnmoleculen te vangen
Als een visnet, nanonet stort in om medicijnmoleculen te vangen Ideeën voor Science Fair-projecten met honden
Ideeën voor Science Fair-projecten met honden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

