
Wetenschap
Hoe veranderende laboratoria een chemische reactiesleutel tot cataractvorming onthulden?
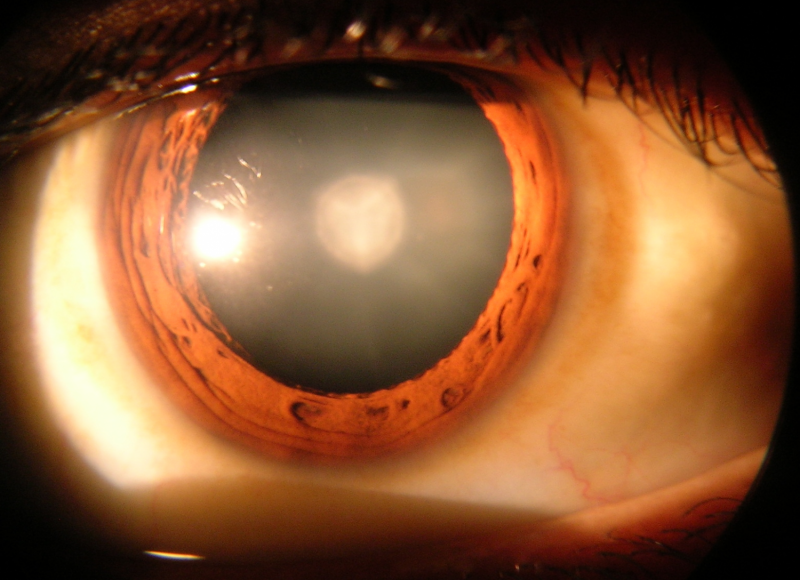
Cataract in het menselijk oog. Krediet:Wikipedia.
Onderzoekers die de biochemie van cataractvorming proberen te begrijpen, hebben een verrassende bevinding gedaan:een eiwit waarvan lang werd aangenomen dat het inert was, heeft eigenlijk een belangrijke chemische functie die de ooglens beschermt tegen cataractvorming.
De lens bestaat uit cellen vol met structurele eiwitten die kristallines worden genoemd. Kristallijnen in elke lenscel vormen een eiwitrijke gel, en de optische eigenschappen van de gel, zoals de transparantie en de manier waarop het licht breekt, helpen het licht op het netvlies te concentreren.
Maar als kristallijne eiwitten samenklonteren, ze zijn niet meer zo transparant. Als genoeg van de eiwitten van hun gebruikelijke in water oplosbare dicht opeengepakte organisatie tot klonterige aggregaten, ze beginnen binnenkomend licht te verstrooien, vorming van troebele afzettingen bekend als cataracten.
Volgens Harvard postdoctoraal fellow Eugene Serebryany, hoofdauteur van een recente studie in de Tijdschrift voor biologische chemie , lange tijd geloofden onderzoekers dat kristallijne eiwitten chemisch inert waren. Dat is, behalve voor het optellen als individuele leeftijden, de eiwitten werden niet verondersteld om veel interactie met collega-eiwitten. Serebryany zei, "Dit was het model:de echte functie van (crystallin) is om monomeer en transparant te blijven en aggregatie zo lang mogelijk te vermijden."
Toen hij afstudeerde aan het MIT, Serebryany gebruikte een gemuteerde vorm van het lenseiwit gamma-kristallijn om UV-schade aan het eiwit na te bootsen. Terwijl we bestuderen hoe die mutatie kristalline ertoe brengt om te aggregeren tot klonten, Serebryany vond iets verrassends:de mutant had meer kans om te aggregeren als wildtype, of onbeschadigd, eiwit was ook aanwezig.
Harvard-professor Eugene Shakhnovich, die samenwerkte met Serebryany en zijn afgestudeerde adviseur, Jonatan Koning, over de eerdere onderzoeken, beschreef de bevinding als "een vrij opvallend fenomeen" en legde uit:"Als je deze beschadigde eiwitten in een reageerbuis had, ze zouden een tijdje niet samenkomen. Als je het wildtype eiwit had, het zou niet voor altijd samenkomen. Maar dan, als je de twee mengt, je ziet een snelle en steile aggregatie."
Met andere woorden, de gezonde versie van een eiwit waarvan iedereen dacht dat het inert was, zorgde er op de een of andere manier voor dat een licht beschadigde versie veel erger werd - en snel.
Toen Serebryany afstudeerde, Shakhnovich huurde hem in om te blijven werken om te begrijpen hoe een zogenaamd inactief eiwit dit effect zou kunnen veroorzaken. Serebryany zei, "Het eerste wat ik moest doen, was eigenlijk proberen om de experimenten van mijn doctoraatslab in dit (nieuwe) lab te laten werken."
"Ze zijn slechts twee haltes van elkaar verwijderd in de metro!" Shakhnovich grapte.
Maar, om de een of andere reden, Serebryany had problemen met het repliceren van de resultaten. "Het is een andere plaats, het is een ander instrumentarium, een iets andere reeks procedures. Je ziet waar dit heen gaat, "zei hij. "Plotseling, experimenten die voorheen zeer reproduceerbaar waren, gaven veel variabiliteit."
Inderdaad, in het Harvard-lab zorgde het wild-type crystalline er soms voor dat mutant crystalline aggregeerde, en soms niet. De wetenschappers waren verbijsterd.
Serebryany zei, "Blijkbaar, als er plotseling variabiliteit is, er is een verborgen variabele die we nog niet eerder hebben gezien." Hij zette een reeks experimenten op om die variabele te lokaliseren.
Een nauwkeurige vergelijking van de molecuulgewichten van het wildtype eiwit dat ervoor zorgde dat de mutant samenklonterde en het eiwit dat geen verschil aantoonde dat gelijk is aan het gewicht van twee waterstofatomen. Dit gaf de onderzoekers een hint dat de redoxtoestand - of twee zwavelatomen in een eiwitmolecuul aan elkaar waren gebonden in plaats van aan waterstofatomen - een verschil zou kunnen maken.
"Door isotopisch opgeloste massaspectrometrie-experimenten uit te voeren, we kregen meer dan we hadden verwacht, " legde Serebryany uit. "Niet alleen kreeg de aggregatiegevoelige mutant één interne disulfidebinding per molecuul tijdens de aggregatiereactie, maar het aggregatiebevorderende wildtype eiwit verloor tegelijkertijd zijn disulfide."
Door de zwavelbevattende cysteïne-aminozuurresiduen één voor één te muteren tot niet-zwavelbevattende residuen, Serebryany ontdekte dat twee cysteïne-aminozuren dicht bij elkaar op het oppervlak van gamma-d-kristallijn als een soort schakelaar fungeerden. Toen de twee bonden, een structuur maken die een disulfidebinding wordt genoemd, crystallin leek in staat om beschadigde collega-moleculen naar aggregatie te duwen. Wanneer de twee cysteïnes niet gebonden waren, elk nam in plaats daarvan een waterstofatoom aan, wat de kleine verandering in massa van het eiwit verklaart. Onder die voorwaarde, wildtype kristalline was inert.
Maar hoe kan een binding tussen aminozuren op het oppervlak van dit eiwit ervoor zorgen dat andere eiwitten gaan aggregeren?
Met behulp van biofysische en biochemische technieken, het team ontdekte dat hoewel de disulfidebinding zich gemakkelijk vormt, het introduceert ook spanning in de structuur van het eiwit. Hierdoor is het waarschijnlijk dat elk eiwitmolecuul langs de disulfidebinding gaat naar een nabijgelegen molecuul van het eiwit, in ruil daarvoor twee protonen ontvangen. Op deze manier kon de disulfidebinding constant worden doorgegeven tussen kristallijne eiwitmoleculen. De auteurs vergeleken het proces met het passeren van een hete aardappel.
Gegeven een hele populatie van gezonde, onbeschadigde kristallijne eiwitten, dit proces kan oneindig doorgaan. Maar als één eiwit al een beetje beschadigd was, de auteurs toonden, het ving de hete aardappel met een andere set cysteïnes, die het minder goed konden doorgeven. Dit zorgde ervoor dat het beschadigde eiwit klonterde. Het eerdere werk van de auteurs onthulde dat mutaties die schade nabootsen veroorzaakt door UV de stabiliteit van het eiwit veranderden, waardoor het meer floppy, en daarom meer kans om de conformatie te verwerven die nieuwe cysteïnes blootlegt die de hete aardappel zouden kunnen vangen.
Dit helpt ons de vorming van cataract te begrijpen. Volgens Shakhnovich, het team werkt aan peptidebehandelingen die kunnen voorkomen dat de "hete aardappel" beschadigde eiwitten bereikt. Serebryany hoopt dat dergelijke peptiden "sommige van die disulfiden kunnen opnemen en de tijd kunnen vertragen die nodig is om de meer aggregatiegevoelige soorten te vormen." Dat zou kunnen leiden tot een langzamere cataractvorming voor patiënten.
 Natures sweets:een natuurlijk recept lenen voor suikersynthese
Natures sweets:een natuurlijk recept lenen voor suikersynthese Detectie van een ongekende reeks potentieel schadelijke stoffen in de lucht
Detectie van een ongekende reeks potentieel schadelijke stoffen in de lucht Oplossing voor fout in synchrotron-onderzoek kan de resultaten verbeteren
Oplossing voor fout in synchrotron-onderzoek kan de resultaten verbeteren Een stap dichter bij ontwerp-on-demand steigers voor weefselregeneratie
Een stap dichter bij ontwerp-on-demand steigers voor weefselregeneratie De top vijf vreemdste vergiften die je kunnen doden
De top vijf vreemdste vergiften die je kunnen doden
 NYC onderneemt stappen om pensioenfondsen van fossiele brandstoffen af te stoten
NYC onderneemt stappen om pensioenfondsen van fossiele brandstoffen af te stoten Flinterdun:recyclageactie op Thaise top bespot door milieuactivisten
Flinterdun:recyclageactie op Thaise top bespot door milieuactivisten IJsberg doemt op boven Groenlands dorp gezien vanuit de ruimte
IJsberg doemt op boven Groenlands dorp gezien vanuit de ruimte Ontkenning van overstromingsrisico in kustgemeenschappen in de VS
Ontkenning van overstromingsrisico in kustgemeenschappen in de VS Januari was de warmste maand ooit gemeten in Nieuw-Zeeland
Januari was de warmste maand ooit gemeten in Nieuw-Zeeland
Hoofdlijnen
- Hoe overtuigend is een Y-chromosoomprofielmatch tussen verdachte en plaats delict?
- Hoe toxoplasmose immuuncellen uitbuit om de hersenen te bereiken?
- De wereldwijde impact van krimpende gletsjers op ongewervelde rivieren in kaart brengen
- Muggendarmbacteriën kunnen aanwijzingen bieden voor malariabestrijding
- Hoe goede bacteriën je genen beheersen
- Grote bedreigingen voor bodemecosystemen door een combinatie van invasieve soorten en klimaatverandering
- Hoe polyfasische slaap werkt
- Laat mijn brein me dingen kopen die ik niet nodig heb?
- Erfelijkheid: definitie, factor, soorten en voorbeelden
- Galvaniseren levert hoge energie, krachtige batterijen
- Hoe mosselen een krachtige onderwaterlijm maken

- 2-D moleculaire kristallen die de elektronische eigenschappen van organische halfgeleiders moduleren
- Coördinatiepolymeerglas biedt solide ondersteuning voor waterstofbrandstofcellen

- Onderzoekers stellen nieuwe krachtige dual-ion-batterijen voor met een 3D-poreuze structuur
 3 schot in YouTube-kantooraanval; verdacht gehate bedrijf
3 schot in YouTube-kantooraanval; verdacht gehate bedrijf Gebruik van elektromagneten in kranen
Gebruik van elektromagneten in kranen  Airbus onthult baanbrekende drone op zonne-energie
Airbus onthult baanbrekende drone op zonne-energie Nieuwe methode om trillingsfrequenties in moleculaire waterstofionen te meten
Nieuwe methode om trillingsfrequenties in moleculaire waterstofionen te meten Individuele onderwijsprogramma's die niet worden gebruikt zoals bedoeld in het speciaal onderwijs
Individuele onderwijsprogramma's die niet worden gebruikt zoals bedoeld in het speciaal onderwijs Is het coronavirus een crisis te ver gebleken voor de extreemrechtse buitenstaanders van Europa?
Is het coronavirus een crisis te ver gebleken voor de extreemrechtse buitenstaanders van Europa? Nieuwe waterdichtings- en aangroeiwerende materialen ontwikkeld
Nieuwe waterdichtings- en aangroeiwerende materialen ontwikkeld COVID-19-virus overleeft op oppervlakken binnen dunne film
COVID-19-virus overleeft op oppervlakken binnen dunne film
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

