
Wetenschap
Nieuwe tools om fysische eigenschappen van biofilms te karakteriseren
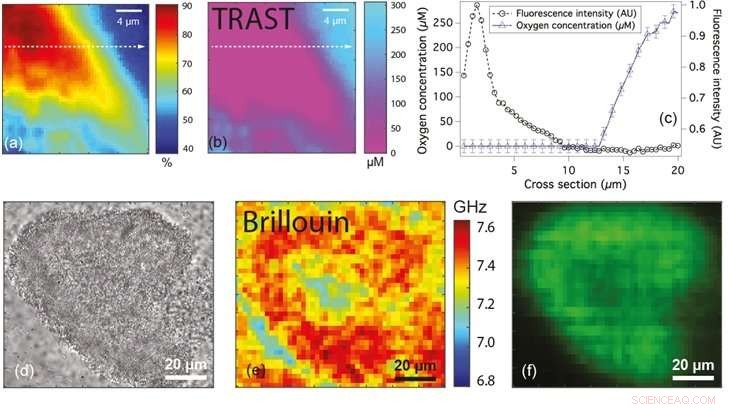
Figuren (a) en (b) tonen respectievelijk de fluorescentie- en zuurstofconcentratiekaart van een microkolonie van bacteriën. Figuur (c) toont het lijnprofiel van fluorescentie (cirkels) en zuurstofconcentratie (driehoeken) langs de stippellijn in (a) en (b). Cijfers (d), (e) en (f) zijn de groothoekmicroscopische, Brillouin- en fluorescentiebeelden van respectievelijk een microkolonie van bacteriën die verschillen in frequentieverschuiving tonen, die kan worden gebruikt om de toestand van de biofilm te classificeren. Krediet:Nationale Universiteit van Singapore
NUS-wetenschappers, samen met onderzoekers van Nanyang Technological University (NTU) en Imperial College London (ICL), hebben niet-invasieve biofysische technieken ontwikkeld om de zuurstofconcentratie en micromechanische eigenschappen in bacteriële biofilms te kwantificeren en hun realtime reacties op omgevingsveranderingen te begrijpen.
Gemeenschappen van bacteriën, schimmels, protozoa of algen die aan elkaar of oppervlakken hechten, worden biofilms genoemd. De biofilms worden gekenmerkt door een verscheidenheid aan eigenschappen die niet typisch worden gevonden in geïsoleerde vrijlevende organismen. Een van de opkomende eigenschappen van biofilms die relevant zijn in de context van de menselijke gezondheid, is hun verhoogde tolerantie voor ontsmettingsmiddelen en antibiotica. Hoewel sommige biofilms gunstig zijn (bijvoorbeeld die welke betrokken zijn bij afvalwaterzuivering en bioremediatie), vele andere zijn schadelijk (bijvoorbeeld die welke betrokken zijn bij infecties en corrosie). Zoals bij elk levend organisme, biofilms passen zich voortdurend aan en reageren op een verscheidenheid aan omgevingsstress, zoals veranderingen in de beschikbaarheid van voedingsstoffen of zuurstof.
Zuurstof speelt een essentiële rol bij het opwekken van energie voor celonderhoud en -groei. Het kwantificeren van de hoeveelheid zuurstof is nodig om de effecten ervan tijdens de verschillende stadia van biofilmgroei te bestuderen. Huidige instrumenten voor het meten van zuurstofniveaus in biofilms verbruiken ofwel zelf zuurstof (wat leidt tot minder nauwkeurige resultaten) of kunnen alleen nauwkeurige metingen verkrijgen vanaf het oppervlak, maar niet binnen de biofilms.
Om deze beperkingen te overwinnen, Prof Thorsten WOHLAND van de departementen Biologische Wetenschappen en Scheikunde, NUS heeft samen met prof. Yehuda COHEN en prof. Scott RICE van NTU een niet-invasieve techniek genaamd Transient State (TRAST) beeldvorming aangepast en toegepast om zuurstofniveaus in bacteriële biofilms te kwantificeren. Dit leidde tot de identificatie van zuurstofarme zones binnen de microscopisch kleine kolonies van P. aeruginosa. TRAST is een op luminescentie gebaseerde beeldvormingstechniek. Het is gebaseerd op het feit dat bepaalde fluoroforen (een soort fluorescerende chemische verbinding) twee verschillende toestanden innemen, één die fluorescentie uitzendt en de andere een niet-fluorescerende donkere toestand. De fractie fluoroforen in de donkere toestand hangt af van hoe vaak de fluoroforen worden geëxciteerd en of ze voldoende tijd krijgen om terug te komen van de donkere toestanden naar de fluorescerende toestanden. Door het verlichtingsschema op gedefinieerde manieren te veranderen, de hoeveelheid fluoroforen over de biofilm (in de donkere toestand) kan gemakkelijk worden gemeten. De metingen zijn alleen afhankelijk van de fractie fluoroforen in de donkere toestand, wat betekent dat de nauwkeurigheid niet wordt beïnvloed, zelfs als bepaalde gebieden in de biofilm een hogere fluorofoorconcentratie hebben. Omdat zuurstof de bezetting van donkere staten onderdrukt, en verlaagt zo de fluoroforen die zich in de donkere staat bevinden, TRAST kan worden gebruikt om zuurstofconcentraties te kwantificeren.
Deze tool heeft mogelijke implicaties in de microbiologie om zuurstofrijke en zuurstofarme zones te onderscheiden, die typisch worden ingenomen door respectievelijk aërobe en anaërobe bacteriën in een biofilm met meerdere soorten. Deze differentiatie is belangrijk in de diagnostiek omdat dit helpt bij het identificeren van het type bacterie op de infectieplaats.
Hetzelfde onderzoeksteam heeft in samenwerking met Prof Peter TÖRÖK van ICL ook een techniek ontwikkeld met behulp van Brillouin-microscopie om de mechanische eigenschappen van biofilms op micrometerschaal te onderzoeken. Brillouin-microscopie maakt de kwantificering van samendrukbaarheid mogelijk door de verschuiving in de frequentie van invallend licht bij interactie met de biofilm te meten. De samendrukbaarheid van een materiaal is de hoeveelheid spanning die nodig is om een verandering in het volume van een materiaal te veroorzaken. De samendrukbaarheid van een materiaal kan worden geïnterpreteerd in termen van de stijfheid van het materiaal. Materialen met grotere frequentieverschuivingen zijn stijver dan materialen met kleinere frequentieverschuivingen. Deze techniek, die "labelvrij" is (d.w.z. geen vreemde moleculen gebruikt), kan mogelijk worden gebruikt om de micromechanische eigenschappen van complexe biofilms te begrijpen.
Prof Wohland zei:"Biofilms kunnen destructieve effecten hebben, bijvoorbeeld bij wondinfectie of bij de afbraak van materialen. Echter, ze kunnen ook worden ingezet voor de productie van biologische materialen of andere processen. Voor beide toepassingen is een goed begrip nodig van de fysische en fysiologische eigenschappen van biofilms. Daarom, nieuwe gereedschappen, zoals ons team zich heeft ontwikkeld, zijn nodig om biofilms in hun natuurlijke omgeving beter te karakteriseren."
 Orkaanwaarschuwingen terwijl de Amerikaanse Golfkust zich schrap zet voor Gordon
Orkaanwaarschuwingen terwijl de Amerikaanse Golfkust zich schrap zet voor Gordon Marine Ecosystem Classification
Marine Ecosystem Classification  Het snel bevolkte kustgebied van de Golf tot Pakistan wordt geconfronteerd met een enorm tsunami-risico
Het snel bevolkte kustgebied van de Golf tot Pakistan wordt geconfronteerd met een enorm tsunami-risico Plastic gevonden in Britse zeevogelnesten op zorgwekkende schaal
Plastic gevonden in Britse zeevogelnesten op zorgwekkende schaal Tropische cycloon Alcides regenval waargenomen door GPM Satellite
Tropische cycloon Alcides regenval waargenomen door GPM Satellite
Hoofdlijnen
- E. Coli kweken in een petrischaal
- Kun je je familie aanzien voor bedriegers?
- Syngenta schikt Amerikaanse boerenrechtszaken in Chinese maïshandelzaak
- Algen en krill kunnen moeilijk te verkopen zijn voor Europese consumenten
- Wetenschappers identificeren het verband tussen licht en chloroplastontwikkeling
- Wetenschappers ontwikkelen microben om herinneringen aan hun omgeving te vormen
- De verschillen tussen Catecholamines en Cortisol
- Amfibieën redden van een dodelijke schimmel betekent handelen zonder alle antwoorden te weten
- Evidence of Evolution: The Origin of Plants, Animals & Fungi
- Titan-in-a-glass-experimenten duiden op minerale samenstelling van de Saturnusmaan

- Een onderzoeksteam ontwikkelt biotransistoren die de kleinste signalen kunnen detecteren

- Met behulp van licht, rode bloedcellen en een honingbijpeptide om therapeutische eiwitten te leveren
- Het nieuwe coronavirus in de maling nemen met een nephanddruk
- Nieuw faseveranderingsmechanisme zou kunnen leiden tot een nieuwe klasse chemische dampsensoren

 Een op DNA gebaseerde nanogel voor gerichte chemotherapie
Een op DNA gebaseerde nanogel voor gerichte chemotherapie Amazon:van online boekverkoper tot market shaker
Amazon:van online boekverkoper tot market shaker Een 50% -normale oplossing van waterstofchloride
Een 50% -normale oplossing van waterstofchloride Versnelling vinden met constante snelheid
Versnelling vinden met constante snelheid Mensen waren de Neanderthalers niet te slim af,
Mensen waren de Neanderthalers niet te slim af,  Hoe te slagen voor Algebra 1
Hoe te slagen voor Algebra 1 Typen bodem en hun gebruik
Typen bodem en hun gebruik Het voordeel van Moneyball verdwijnt zodra iedereen het doet
Het voordeel van Moneyball verdwijnt zodra iedereen het doet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

