
Wetenschap
Wetenschappers creëren vanuit het niets complexe transmembraaneiwitten
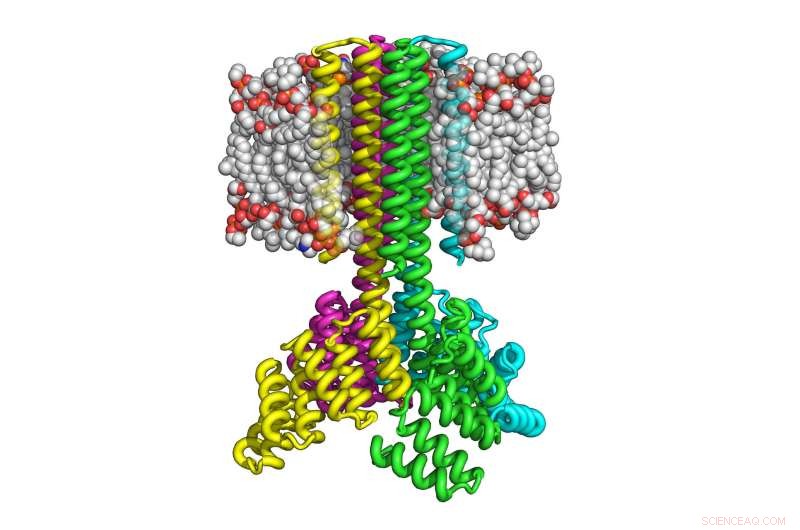
Deze illustratie laat zien hoe vier kopieën van computer-ontworpen transmembraaneiwit geassembleerd werden om een raketvormig tetrameer te vormen met een brede cytoplasmatische basis die uitmondt in acht transmembraanhelices en die correct oriënteert in het membraan. Krediet:University of Washington Institute for Protein Design
Het is nu mogelijk om complexe, op maat ontworpen transmembraaneiwitten helemaal opnieuw, Dat melden wetenschappers deze week. Het voorschot, geleid door moleculaire ingenieurs van het University of Washington Institute for Protein Design, zal onderzoekers in staat stellen om transmembraaneiwitten te creëren die niet in de natuur voorkomen om specifieke taken uit te voeren.
In de levende wereld, transmembraaneiwitten worden gevonden ingebed in het membraan van alle cellen en cellulaire organellen. Ze zijn essentieel om normaal te kunnen functioneren. Bijvoorbeeld, veel natuurlijk voorkomende transmembraaneiwitten fungeren als toegangspoorten voor de beweging van specifieke stoffen door een biologisch membraan. Sommige transmembraaneiwitten ontvangen of zenden celsignalen uit. Door zulke rollen veel medicijnen zijn ontworpen om zich op transmembraaneiwitten te richten en hun functie te veranderen.
"Onze resultaten effenen de weg voor het ontwerp van multispan-membraaneiwitten die eiwitten in de natuur kunnen nabootsen of een geheel nieuwe structuur hebben, functie en gebruik, " zei David Bakker, een University of Washington School of Medicine professor biochemie en directeur van het UW Institute of Protein Design die het project leidde. Het onderzoek wordt gerapporteerd in het nummer van 1 maart van het tijdschrift Wetenschap . Peilong Lu, een senior fellow in het Baker-lab, is de hoofdauteur van de krant.
Maar het is een uitdaging gebleken om te begrijpen hoe transmembraaneiwitten in elkaar zitten en hoe ze werken. Omdat ze werken terwijl ze zijn ingebed in het celmembraan, transmembraaneiwitten blijken moeilijker te bestuderen dan eiwitten die werken in de waterige oplossing die het cytoplasma van de cellen vormt of in de extracellulaire vloeistof.
In de nieuwe studie Lu en zijn collega's gebruikten een computerprogramma, ontwikkeld in het Baker-lab en Rosetta genoemd, die de structuur kan voorspellen waarin een eiwit zal vouwen nadat het is gesynthetiseerd. De architectuur van een eiwit is cruciaal omdat de structuur van een eiwit zijn functie bepaalt.
De vorm van een eiwit ontstaat door complexe interacties tussen de aminozuren die de eiwitketen vormen en tussen de aminozuren en de omgeving. uiteindelijk, het eiwit neemt de vorm aan die al deze factoren het best in evenwicht houdt, zodat het eiwit de laagst mogelijke energietoestand bereikt.
Het Rosetta-programma dat door Lu en zijn collega's wordt gebruikt, kan de structuur van een eiwit voorspellen door met deze interacties rekening te houden en de laagste algemene energietoestand te berekenen. Het is niet ongebruikelijk dat het programma tienduizenden modelstructuren voor een aminozuursequentie maakt en vervolgens degene met de laagste energietoestand identificeert. Van de resulterende modellen is aangetoond dat ze nauwkeurig de structuur weergeven die de reeks waarschijnlijk in de natuur zal aannemen.
Het bepalen van de structuur van transmembraaneiwitten is moeilijk omdat delen van transmembraaneiwitten door het binnenste van het membraan moeten gaan, die is gemaakt van olieachtige vetten die lipiden worden genoemd.
In waterige vloeistoffen, aminozuurresiduen met polaire zijketens - componenten die onder bepaalde fysiologische omstandigheden een lading kunnen hebben of die deelnemen aan waterstofbinding - bevinden zich meestal op het oppervlak van het eiwit waar ze kunnen interageren met water, die negatieve en positieve zijladingen heeft voor zijn molecuul. Als resultaat, polaire residuen op eiwitten worden hydrofiel genoemd, of 'waterminnend'.
Niet-polaire residuen, anderzijds, hebben de neiging te worden gevonden verpakt in de eiwitkern, weg van de polaire waterige vloeistof. Dergelijke residuen worden hydrofoob of "watervrezend" genoemd. Als resultaat, de interactie tussen de waterminnende en watervrezende resten van het eiwit en de omringende waterige vloeistoffen helpt de eiwitvouwing te stimuleren en stabiliseert de uiteindelijke structuur van het eiwit.
Bij membranen, echter, eiwitvouwing is ingewikkelder omdat het lipide-interieur van het membraan niet-polair is, dat is, het heeft geen scheiding van elektrische ladingen. Dit betekent dat om stabiel te zijn, het eiwit niet-polaire, waterafstotende resten op het oppervlak, en pak zijn polaire, waterminnende resten binnenin. Dan moet het een manier vinden om zijn structuur te stabiliseren door bindingen te creëren tussen de hydrofiele resten in zijn kern.
De sleutel tot het oplossen van het probleem, zegt Lu, was om een door Baker Lab ontwikkelde methode toe te passen om eiwitten zo te ontwerpen dat de polaire, hydrofiele residuen passen op een zodanige manier dat er voldoende polair-polaire interacties zouden zijn die het eiwit van binnenuit aan elkaar kunnen binden.
"Het samenstellen van deze 'begraven waterstofbrugnetwerken' was als het leggen van een legpuzzel, ' zei Bakker.
Met deze aanpak, Lu en zijn collega's waren in staat om de ontworpen transmembraaneiwitten in bacteriën en zoogdiercellen te produceren door maar liefst 215 aminozuren te gebruiken. De resulterende eiwitten bleken zeer thermisch stabiel te zijn en in staat om zich correct op het membraan te oriënteren. Net als natuurlijk voorkomende transmembraaneiwitten, de eiwitten zijn multipass, wat betekent dat ze meerdere keren door het membraan gaan, en assembleren tot stabiele multi-eiwitcomplexen, zoals dimeren, trimeren en tetrameren.
"We hebben laten zien dat het nu mogelijk is om complexe, multipass transmembraaneiwitten die in cellen tot expressie kunnen worden gebracht. Dit zal het voor onderzoekers mogelijk maken om transmembraaneiwitten te ontwerpen met geheel nieuwe structuren en functies, " zei Lu.
Hoofdlijnen
- Wat is het laatste nieuws over de darmflora? Concordia-studenten microbiologie publiceren hun bevindingen
- Gewassen evolueerden 10 millennia eerder dan gedacht
- Hoe zijn planten en dieren afhankelijk van elkaar?
- Wat zijn enkele voor- en nadelen van het gebruik van DNA-analyse om wetshandhaving bij misdrijven te ondersteunen?
- Zullen we binnenkort uitgestorven zijn?
- Wat zijn genetisch gemodificeerde organismen (GGO's)? Zijn ze veilig?
- Bio-ethicus bespreekt vier sleutels om te weten over mogelijkheden, valkuilen van genbewerking
- Verklaring van celspecialisatie
- Appelbomen dragen meer fruit als ze omringd zijn door goede buren
- Kleine biologisch afbreekbare circuits voor het vrijgeven van pijnstillers in het lichaam

- Aan de lijn:kijken hoe nanodeeltjes vorm krijgen

- Team verlicht de micro-omgeving, een nieuwe weg naar kankermedicijnen creëren
- snel, flexibele wateranalyse zorgt voor opschudding in de industrie

- Epoxyharsen:uitharden met een druk op de knop

 Q&A:Duurzaamheidsmanager over de voordelen van een verbod op plastic tassen
Q&A:Duurzaamheidsmanager over de voordelen van een verbod op plastic tassen Instrument kan mail-in-testen mogelijk maken om zware metalen in water te detecteren
Instrument kan mail-in-testen mogelijk maken om zware metalen in water te detecteren Onderzoek met leidinggevenden uit de sector onthult de impact van COVID-19 op de luchtvervoersector
Onderzoek met leidinggevenden uit de sector onthult de impact van COVID-19 op de luchtvervoersector Hoe natriumcarbonaatoplossing maken
Hoe natriumcarbonaatoplossing maken Sporenvormingsmodel kan de geneeskunde vooruithelpen
Sporenvormingsmodel kan de geneeskunde vooruithelpen Tesla levert eerste in China gemaakte Model 3 aan klanten
Tesla levert eerste in China gemaakte Model 3 aan klanten Hoe de lading van transitie te bepalen Metaalionen
Hoe de lading van transitie te bepalen Metaalionen  NASA's TESS-ruimtevaartuig vindt honderden exoplaneten - en staat klaar om er nog duizenden te vinden
NASA's TESS-ruimtevaartuig vindt honderden exoplaneten - en staat klaar om er nog duizenden te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


