
Wetenschap
Nieuwe structuur van sleuteleiwit bevat aanwijzingen voor een beter medicijnontwerp
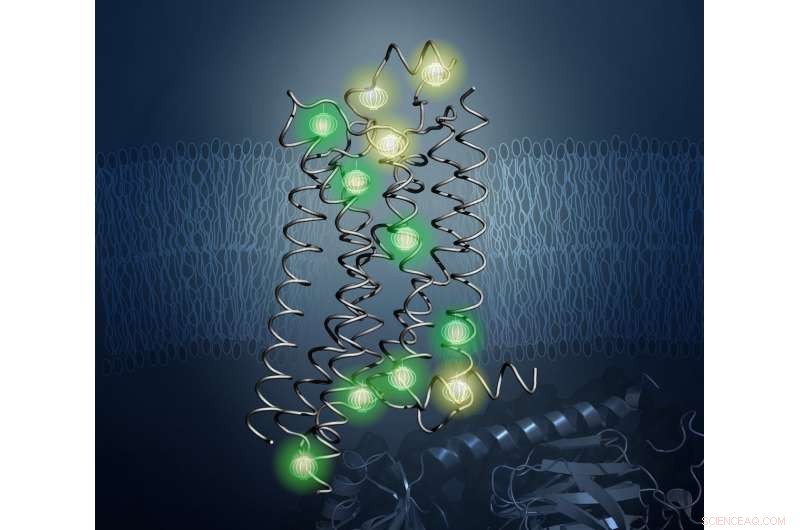
Probes (hier gloeiend weergegeven) onthulden de innerlijke architectuur van het eiwit A2aAR in de nieuwe studie. Krediet:Kurt Wuthrich en Matthew Eddy, Het Scripps-onderzoeksinstituut
Wetenschappers van het Scripps Research Institute (TSRI) hebben diep in het hart van een belangrijk eiwit dat wordt gebruikt bij het ontwerpen van geneesmiddelen gekeken en dynamische structurele kenmerken ontdekt die kunnen leiden tot nieuwe manieren om ziekten aan te pakken. het eiwit, genaamd de A 2A adenosine receptor (A 2a AR), is een lid van de G-proteïne-gekoppelde receptor (GPCR) familie, die het doelwit zijn van ongeveer 40 procent van alle goedgekeurde geneesmiddelen.
De nieuwe, meer gedetailleerde afbeelding van A 2a AR's signaleringsmechanisme onthult belangrijke delen van zijn innerlijke werking, inclusief een aminozuur dat werkt als een "tuimelschakelaar" om de signalering over het celmembraan te regelen.
"Deze basiskennis is mogelijk nuttig voor het verbeteren van het medicijnontwerp, ", zegt Nobelprijswinnaar Kurt Wthrich, doctoraat, de Cecil H. en Ida M. Green hoogleraar structurele biologie aan TSRI en senior auteur van de studie.
De bevindingen zijn vandaag gepubliceerd in het tijdschrift Cel .
Beeldvormingstechniek onthult hoe eiwit van vorm verandert
Alle menselijke cellen bevatten A 2a AR en andere GPCR's ingebed in hun plasmamembraan. Er zijn meer dan 800 GPCR's ontdekt in het menselijk lichaam, en elk heeft een rol bij het reguleren van een lichaamsfunctie. Bijvoorbeeld, EEN 2a AR reguleert de bloedstroom en ontstekingen en bemiddelt de effecten van cafeïne. EEN 2a AR is ook een gevalideerd doelwit voor de behandeling van de ziekte van Parkinson en een relatief nieuw doelwit voor kankerbestrijding.
"GPCR's doen zo ongeveer alles wat je maar kunt bedenken, " zegt Wthrich. "Maar voor een lange tijd, medicijnontwerp werd gedaan zonder te weten hoe GPCR's eruit zagen."
Voor de nieuwe studie de onderzoekers wilden de relatie tussen A . beter begrijpen 2a AR-functie en dynamische veranderingen in de structuur om het ontwerp van geneesmiddelen te helpen informeren.
Het onderzoek bouwde voort op eerdere studies waarbij wetenschappers een beeldvormingstechniek gebruikten die röntgenkristallografie wordt genoemd om A . te bepalen 2a AR's driedimensionale structuur. De beelden toonden aan dat A 2a AR ziet eruit als een ketting die het celmembraan doorkruist en een opening heeft aan de kant die naar buiten gericht is. Het gebied van de GPCR-structuur dat uit het membraan steekt, interageert met medicijnen en andere moleculen om te signaleren naar partnereiwitten in de cel.
Hoewel kristalstructuren een belangrijk overzicht gaven van de vorm van de receptor in inactieve en actief-achtige toestanden, ze konden geen beweging en veranderingen in structuur laten zien wanneer A 2a AR ontmoet nieuwe bindende partners, zoals farmaceutische kandidaten. Kortom, de onderzoekers in de nieuwe studie moesten onderzoeken waarom A 2a AR werkt zoals het werkt.
Om dit probleem op te lossen, de onderzoekers gebruikten een techniek genaamd nucleaire magnetische resonantie (NMR) spectroscopie, die sterke magnetische velden creëert om de posities van sondes in een monster te lokaliseren. Wthrich is een wereldberoemde leider op het gebied van NMR en won in 2002 de Nobelprijs voor Scheikunde voor baanbrekend werk op het gebied van NMR om de structuren van biologische moleculen te bestuderen. Met NMR, wetenschappers kunnen de structuren van eiwitten bepalen en hun dynamische eigenschappen bestuderen in oplossing bij fysiologische temperaturen - zoals ze in het menselijk lichaam voorkomen.
In werk onder leiding van Matthew Eddy van TSRI, doctoraat, eerste auteur van de nieuwe studie, de onderzoekers gebruikten NMR om A . te observeren 2a AR in veel verschillende conformaties, licht werpen op hoe het van vorm verandert op het oppervlak van menselijke cellen als reactie op medicamenteuze behandelingen.
belangrijk, NMR liet het team veranderingen in de interne architectuur van A . visualiseren 2a AR. Dit bracht hen verder dan eerdere NMR-onderzoeken naar oplossingen, die zich richtte op de technisch minder veeleisende observatie van NMR-waarneembare sondes die zijn bevestigd aan flexibele delen van GPCR's, meestal gelokaliseerd op of nabij het oppervlak van de receptor. De aanpak in de nieuwe studie stelde onderzoekers in staat om de effecten van geneesmiddelbinding aan het extracellulaire oppervlak op veranderingen in eiwitstructuur en dynamiek aan het intracellulaire oppervlak - de structurele basis van signaaloverdracht - over het hart van de GPCR te volgen.
Het was alsof de onderzoekers een auto hadden gezien, en met NMR, ze konden eindelijk de motor inspecteren.
Heroverwegen hoe we medicijnen ontwerpen
Twee details in A 2a De structuur van AR gaf onderzoekers inzicht in hoe toekomstige medicijnen de receptor zouden kunnen manipuleren. Een belangrijke bevinding was dat het vervangen van een bepaald aminozuur in het centrum van de receptor het vermogen van de receptor om signalen de cel in te sturen vernietigde.
"Met deze bevinding we kunnen zeggen 'A-ha! Het is deze verandering in structuur die de signaleringsactiviteit doodt.' Misschien kunnen we een medicijn veranderen om deze limiet te overwinnen, ' zegt Wthrich.
De onderzoekers onthulden ook de activiteit van een "tuimelschakelaar" in A 2a AR. Eerdere studies suggereerden dat een van de tryptofaan-aminozuren in A 2a AR klapt op en neer in overleg met A 2a activiteit van AR. Met NMR, de wetenschappers observeerden dit unieke tryptofaan direct toen het van oriëntatie veranderde als reactie op verschillende medicijnen. Chemici zouden mogelijk medicijnen kunnen aanpassen om deze schakelaar te manipuleren en A . onder controle te houden 2a AR-signalering.
De onderzoekers benadrukken dat deze nieuwe studie potentieel relevant is voor een groot deel van de grote familie van GPCR's. In feite, structurele details van deze studie kunnen van toepassing zijn op meer dan 600 "klasse A" GPCR's in ons lichaam.
Naast Wthrich en Eddy, auteurs van de studie, "Allosterische koppeling van medicijnbinding en intracellulaire signalering in de A 2a adenosine receptor, " were Tatiana Didenko and Pawel Stanczak of The Scripps Research Institute; Reto Horst of The Scripps Research Institute and Pfizer Worldwide Research and Development; Zhan-Guo Gao and Kenneth A. Jacobson of the National Institutes of Health; and Ming-Yue Lee, Kyle M. McClary, Gye Won Han, Martin Audet, Kate L. White and Raymond C. Stevens of the University of Southern California.
 NASA-NOAA-satelliet vindt ontwikkeling van tropische cycloon Sarai
NASA-NOAA-satelliet vindt ontwikkeling van tropische cycloon Sarai Klimigratie:wanneer gemeenschappen moeten verhuizen vanwege klimaatverandering
Klimigratie:wanneer gemeenschappen moeten verhuizen vanwege klimaatverandering Ontwikkelingsdilemma terwijl Oost-Groenland het toerisme stimuleert
Ontwikkelingsdilemma terwijl Oost-Groenland het toerisme stimuleert Heeft MRI een milieu-impact?
Heeft MRI een milieu-impact? Wat gebeurt er met kelpbossen wanneer er geen zeeëgels aanwezig zijn in het ecosysteem?
Wat gebeurt er met kelpbossen wanneer er geen zeeëgels aanwezig zijn in het ecosysteem?
Hoofdlijnen
- Metrowerk in Los Angeles onthult een reeks fossielen uit de ijstijd (update)
- Kunstmatige neurale netwerken kunnen het beheer van natuurhistorische collecties stimuleren
- Het overdrachtspotentieel van vliegen kan groter zijn dan gedacht, onderzoekers zeggen:
- Wat zijn de spoelen van DNA in de kern?
- Plantverdediging volgens het iron-maiden-principe
- Losse huid en slap volume beschermen Hagfish tegen haaienbeten
- Biologen maken toolkit voor het afstemmen van genetische circuits
- Op weg naar pesticidebewaking
- Europese topkoks schrappen elektrisch pulsvissen van het menu
- Nieuwe doelwitten in de strijd tegen antibioticaresistentie

- Nieuwe methode voor snellere en eenvoudigere productie van gelipideerde eiwitten

- Op polymeer gebaseerde coatings op metalen implantaten verbeteren de integratie van bot-implantaten
- Ontdekking daagt geaccepteerde regel van organisch zonnecelontwerp uit

- Stabiliserende eigenschappen van vurengom kunnen worden aangepast met behulp van extractietechnieken

 Een beetje rijk:bedrijfsgroepen willen dringende klimaatactie na 30 jaar weerstand te hebben geboden
Een beetje rijk:bedrijfsgroepen willen dringende klimaatactie na 30 jaar weerstand te hebben geboden Organismen die groeien op een voedingsagentplaat
Organismen die groeien op een voedingsagentplaat Fukushima:Waarom we duizenden jaren terug moeten kijken om beter te worden in het voorspellen van aardbevingen
Fukushima:Waarom we duizenden jaren terug moeten kijken om beter te worden in het voorspellen van aardbevingen Dit gebeurt er als gelaagde materialen tot het uiterste worden geduwd
Dit gebeurt er als gelaagde materialen tot het uiterste worden geduwd Over gezichten:Geometrische stijl van portretkunst
Over gezichten:Geometrische stijl van portretkunst Wat we hebben geleerd van dinosaurustanden in Noord-Afrika
Wat we hebben geleerd van dinosaurustanden in Noord-Afrika Oeganda's Ik zijn niet ongelooflijk egoïstisch en gemeen
Oeganda's Ik zijn niet ongelooflijk egoïstisch en gemeen Duizenden vluchten voor uitbarstende Filipijnse vulkaan
Duizenden vluchten voor uitbarstende Filipijnse vulkaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

