
Wetenschap
Chemici onthullen één mechanisme van diwaterstofproductie door stikstofase
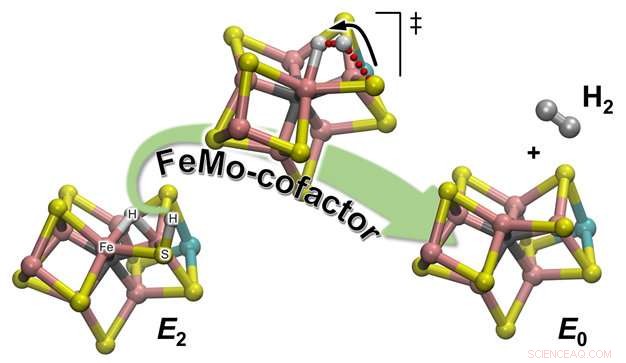
Schematische illustratie van hoe H2 wordt gevormd uit een van de reactie-enzymatische tussenproducten (E2) om de rusttoestand (E0) van de katalytische stikstofcofactor te regenereren, genaamd FeMo-cofactor. Het waterstofatoom dat aan een van de zwavelatomen is gebonden, begint een reis die het zal brengen naar de partner waarmee het het H2-molecuul zal vormen:een waterstofatoom dat geduldig wacht, tussen twee Fe-atomen zitten. Krediet:Pacific Northwest National Laboratory
Nitrogenase staat centraal in het leven op onze planeet. Het levert het grootste deel van de stikstof (N) die wordt gebruikt in eiwitten en nucleïnezuren en het is essentieel bij het maken van planten, dieren en andere organismen, ammoniak (NH3) maken dat vervolgens wordt gebruikt bij de biosynthese van aminozuren en vervolgens eiwitten. Maar terwijl stikstofase aan het werk is, het creëert ook iets anders:diwaterstof (H2). Wetenschappers weten al enige tijd dat stikstofase H2 maakt door twee verschillende processen. Nutsvoorzieningen, een van deze processen wordt duidelijk door het werk van een team van onderzoekers die het mechanisme voor H2-productie hebben bestudeerd.
Nitrogenase zal H2 maken als het wordt uitgevoerd in afwezigheid van N2. Dit werd gezien als een "relaxatie" van de actieve plaats van het enzym die is geladen met ijzerhydriden die nodig zijn voor de N2-reductiereactie. Maar wat is het mechanisme voor hoe de ijzerhydriden van de actieve site van stikstofase ontspannen om deze H2 te maken? Een team van wetenschappers van het Pacific Northwest National Laboratory, de staatsuniversiteit van Utah, Noordwestelijke Universiteit, en de Universiteit van Utah probeerde dit H2-relaxatiemechanisme te begrijpen door de effecten van waterstof (H) versus deuterium (D) op de kinetiek van H2-vorming te volgen wanneer stikstofase aan een elektrode wordt bevestigd. Het team ontdekte dat een nabijgelegen H+ eigenlijk de actieve partner was bij de productie van H2 wanneer het wordt gecombineerd met het ijzerhydride om H2 te maken.
"Slechts één proton doet alles, de hydride is slechts een toeschouwer die wacht op wat actie, " bevestigde Simone Raugei, een PNNL-wetenschapper die bij dit werk betrokken is.
Dit is een belangrijke stap op weg naar het begrijpen van stikstofase en hoe en waarom de productie van H2 nodig is voor zijn activiteit. Het illustreert ook een strategie voor mechanistische studie die kan worden toegepast op andere oxidoreductase-enzymen en op biomimetische complexen.
Om de kinetiek van waterstofproductie te isoleren, een team onder leiding van Lance Seefeldt, Brian Hofman, Shelley Minteer, en Simone Raugei gebruikte kleine moleculen om elektronen snel van een elektrode naar de katalytische helft van stikstofase te transporteren. Het volgen van de protonreacties was een lastige en uitdagende taak, zei Seefeldt, dus om nauwkeurigheid te garanderen, volgden ze de proton-"inventaris" (het aantal waterstofatomen dat betrokken is bij de katalytische productie van H2) door kinetische waterstof/deuterium-kinetische metingen uit te voeren.
De resultaten van de experimenten suggereerden dat slechts één waterstof daadwerkelijk betrokken was bij de snelheidsbeperkende stap van H2-vorming, en niet twee, zoals de stoichiometrie van de reactie aangeeft.
De experimentele waarnemingen van het team werden bevestigd door computationele chemie, die een gedetailleerde atomistische beschrijving van het reactiemechanisme opleverde. Er zijn 2 soorten waterstofatomen in de katalytische cofactor (FeMo-co genaamd):de ene bevindt zich in een overbruggende positie waar het zich bindt aan twee ijzeratomen (een overbruggend hydride), en één op een nabijgelegen zwavelatoomliganden (eigenlijk een geprotoneerd zwavelatoom:S-H). Het blijkt dat tijdens de H2-evolutie, de laatste is de actieve partner. De S-H-binding breekt en de resulterende H+ beweegt naar het overbruggende hydride en protoneert het om H2 te vormen:de berekeningen geven een verklaring voor de experimentele waarneming dat slechts één waterstof "actief is, terwijl de ander slechts een toeschouwer is die wacht op de komst van zijn partner.
"De mate van overeenstemming tussen de waarnemingen en de resultaten van de computationele chemie was opmerkelijk hoog, ' zei Raugei.
Dit werk is een cruciale stap in de richting van een mechanistisch begrip van het stikstofase-enzym. Er is nog werk aan de winkel om het mechanisme van het andere H2-evolutieproces dat leidt tot N2-binding te begrijpen, activering, en reductie tot NH3.
 Sensing-technologie identificeert bomen die zijn aangetast door dodelijke lariksziekte
Sensing-technologie identificeert bomen die zijn aangetast door dodelijke lariksziekte 5 groene manieren om goederen te vervoeren
5 groene manieren om goederen te vervoeren  Enorme krater ontdekt in Groenland door inslag op noordelijk halfrond
Enorme krater ontdekt in Groenland door inslag op noordelijk halfrond Offshore onderzeese zoetwaterontdekking wekt hoop voor eilanden wereldwijd
Offshore onderzeese zoetwaterontdekking wekt hoop voor eilanden wereldwijd Tropische bossen kunnen binnenkort een belemmering vormen, geen hulp, inspanning voor klimaatverandering
Tropische bossen kunnen binnenkort een belemmering vormen, geen hulp, inspanning voor klimaatverandering
Hoofdlijnen
- Mitosis vs Meiosis: Wat zijn de overeenkomsten en verschillen?
- Hoe verbeteren microscopen ons leven vandaag?
- Door het bedrijf gesponsorde klinische CRISPR-onderzoeken starten in 2018
- Oorzaken van Cytoplasmic Streaming
- Science Fair Projectideeën voor tandheelkunde
- Menselijk genoom DNA-sequentietypen
- Wat breekt een dubbele DNA-helix uiteen?
- Vergelijking & identificatie van kikkers en menselijke bloedcellen
- Wat is het voordeel van het feit dat het DNA goed is ingepakt in de chromosomen?
- Mechanisme van fotosynthetische watersplitsing onthuld door een röntgenvrije elektronenlaser
- De verschillen tussen zout en suiker

- Eerder onbekende kristallijne fase van halfwaterig calciumcarbonaat ontdekt

- Door de natuur geïnspireerde proteïne kan helpen bij de plasticplaag

- Chemicus die elektrische velden bestudeert, microfluïdica om de dialysetechnologie te verbeteren

 Berekening van diagonale afstand tussen hoeken van een vierkant
Berekening van diagonale afstand tussen hoeken van een vierkant Luchtvaartmaatschappijen in het Midden-Oosten verliezen $ 7 miljard omdat luchthavens gesloten zijn om het virus te bestrijden
Luchtvaartmaatschappijen in het Midden-Oosten verliezen $ 7 miljard omdat luchthavens gesloten zijn om het virus te bestrijden Snelheidsvoorspelling voor homogene nucleatie van methaanhydraat
Snelheidsvoorspelling voor homogene nucleatie van methaanhydraat Maakt u zich geen zorgen over de asteroïde die zaterdag op aarde overgaat
Maakt u zich geen zorgen over de asteroïde die zaterdag op aarde overgaat Opinie:Het einde van de wetenschappelijke, rationeel denken:Donald Trump, Doug Ford en Jordan Peterson
Opinie:Het einde van de wetenschappelijke, rationeel denken:Donald Trump, Doug Ford en Jordan Peterson Britse tiener die CIA-chef hackte krijgt twee jaar cel
Britse tiener die CIA-chef hackte krijgt twee jaar cel Je brein in de ruimte - het overzichtseffect
Je brein in de ruimte - het overzichtseffect Washington Post lanceert commentaarpagina in het Arabisch
Washington Post lanceert commentaarpagina in het Arabisch
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

