
Wetenschap
Kunstmatige enzymfuncties evenals natuurlijke versie
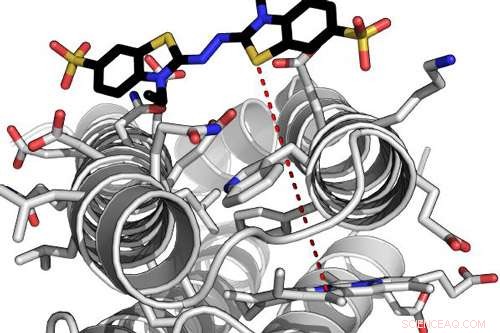
Computationeel model van een zeer efficiënt de novo-enzym dat interageert met een van zijn substraten. De rode stippellijn geeft de elektronentunnelafstand aan tussen het eiwitgebonden heemmolecuul en het gebonden substraat. Krediet:Ross Anderson, Universiteit van Bristol
Wetenschappers van de Universiteit van Bristol hebben een kunstmatig enzym ontworpen dat even goed (en in sommige gevallen beter dan) een vitale klasse van natuurlijke enzymen functioneert.
Enzymen zijn fundamenteel belangrijke biologische moleculen die het grootste deel van de chemische reacties in alle levende organismen uitvoeren.
Deze reacties versterken het cellulaire leven en zijn betrokken bij een groot aantal processen die nodig zijn om cellen hun chemische en fysieke kenmerken te geven.
Verder, veel enzymen nemen deel aan chemische reacties die commerciële of medische waarde hebben, en waarvoor we geen goede kunstmatige stoffen hebben die dergelijke reacties kunnen katalyseren met dezelfde precisie en efficiëntie als enzymen.
Het kunstmatige enzym werd in een volledig functionerende vorm gesynthetiseerd door E. coli-bacteriën en zou van aanzienlijk belang kunnen zijn voor de biotech-industrie vanwege zijn industrieel relevante katalytische activiteiten, thermische stabiliteit en chemische weerstand.
Ze kunnen zelfs worden gebruikt als vervanging voor bepaalde natuurlijke enzymen die complexer en moeilijker op grotere schaal te produceren zijn.
Om dit te bereiken gebruikte het team een aanpak die evolutionaire complexiteit elimineert door kleine, eenvoudige en volledig kunstmatige eiwitten in het ontwerpproces.
Dr. Ross Anderson van de School of Biochemistry van de Universiteit van Bristol, zei:"We beschrijven deze eiwitten als maquettes, een term die in de beeldhouwkunst wordt gebruikt om een schaalmodel aan te duiden waaruit een definitief werk wordt gemaakt.
"De eiwitmaquette stelt de ontwerper op dezelfde manier in staat om functionele elementen op een stabiele eiwitsteiger op te nemen. In dit geval we hebben een eerder maquette-ontwerp aangepast waarbij we de machinerie in een levende bacteriecel gebruikten om het heemmolecuul permanent in de structuur van het eiwit te enten."
De aangebrachte wijzigingen, vergemakkelijkt de binding van waterstofperoxide aan het heemmolecuul, een noodzakelijke stap in katalyse die de peroxidasefamilie van enzymen gemeen heeft.
Met deze veranderingen, de maquette was niet alleen in staat waterstofperoxide te binden, maar ook om het om te zetten in een meer reactieve vorm die elektronen kan trekken uit een reeks eenvoudige organische moleculen, op dezelfde manier dat natuurlijke peroxidasen werken.
Doordat de maquette ook volledig in bacteriecellen is gemonteerd, het gaf het team de mogelijkheid om deze chemische transformaties in levende cellen te benutten, of om te overwegen het te integreren in de metabole routes van een organisme.
Dr. Anderson voegde toe:"Dus in wezen, we hebben een kunstmatig (of de novo) enzym gemaakt dat even goed (en in sommige gevallen beter dan) een vitale klasse van natuurlijke enzymen functioneert.
"Het is promiscue - zoals veel van de natuurlijke peroxidasen zijn - en zou kunnen staan als een robuust prototype van waaruit veel functionele katalysatoren zouden kunnen worden ontwikkeld.
"In katalytische activiteit, het ligt zo dicht bij natuurlijke enzymen (en gezien het feit dat de bacteriën het in een actieve vorm maken), als het zou worden gezuiverd zonder kennis van zijn kunstmatige oorsprong, zou het een natuurlijke functie worden toegeschreven en als een nieuw natuurlijk enzym worden behandeld."
 Gefossiliseerde algen zijn veelbelovend voor verbeterde voedselveiligheidstesten
Gefossiliseerde algen zijn veelbelovend voor verbeterde voedselveiligheidstesten Onderzoekers maken de eerste kaarten van twee melatoninereceptoren die essentieel zijn voor slaap
Onderzoekers maken de eerste kaarten van twee melatoninereceptoren die essentieel zijn voor slaap Moleculaire schalen op biologische membranen
Moleculaire schalen op biologische membranen Zuivere brandstof uit zonlicht halen
Zuivere brandstof uit zonlicht halen Nieuwe stappen voor de dynamiek van polymeerketens
Nieuwe stappen voor de dynamiek van polymeerketens
 bosbranden, houtkap beïnvloedt schimmels waarvan dennenbossen afhankelijk zijn om te overleven, onderzoeken tonen aan
bosbranden, houtkap beïnvloedt schimmels waarvan dennenbossen afhankelijk zijn om te overleven, onderzoeken tonen aan Baanbrekend onderzoek leidt tot nieuw product dat langdurige droogte voorspelt
Baanbrekend onderzoek leidt tot nieuw product dat langdurige droogte voorspelt Hoeveel vis eten we? Eerste wereldwijde voetafdruk van zeevruchtenconsumptie gepubliceerd
Hoeveel vis eten we? Eerste wereldwijde voetafdruk van zeevruchtenconsumptie gepubliceerd Politieke voorkeur beïnvloedt het waterbeleid van de stad even sterk als het klimaat
Politieke voorkeur beïnvloedt het waterbeleid van de stad even sterk als het klimaat Klimaatverandering een halt toeroepen betekent een wereld zonder fossiele brandstoffen – niet alleen het terugdringen van de uitstoot
Klimaatverandering een halt toeroepen betekent een wereld zonder fossiele brandstoffen – niet alleen het terugdringen van de uitstoot
Hoofdlijnen
- Neanderthalers waren eigenlijk prehistorische Picasso's
- Wat zijn natuurlijke polymeren?
Enkele van de meest voorkomende voorbeelden van polymeren zijn kunststoffen en eiwitten. Hoewel plastics het resultaat zijn van het industriële proces, zijn eiwitten rijk aan aard en worden ze daarom meestal als een
- De cyanideverdediging:hoe één bacterie roofdieren remt met gif
- De zoektocht naar de zuidelijke rubberboa
- Onderzoekers creëren 3D-celarrays voor meer realistische experimentele biologische omgevingen
- Unieke manieren om een DNA-model te bouwen
- Burgerwetenschap kan trends in de vlinderpopulatie voorspellen
- Wetenschappers identificeren sleutelfactoren die microben helpen gedijen in ruwe omgevingen
- Een biobank van omkeerbare mutante embryonale stamcellen
- Een nieuwe manier om moleculen te maken voor de ontwikkeling van geneesmiddelen

- Moleculaire simulaties laten zien hoe medicijnen belangrijke receptoren blokkeren

- Precious Metals Extract from Sulfides

- Wat zijn de ladingen van protonen, neutronen en elektronen?

- Onderzoekers ontwerpen polymeer dat resistente bacteriën kan doden
 Soccer Science Fair Ideas
Soccer Science Fair Ideas  Populatieprojecties berekenen
Populatieprojecties berekenen Studie onderzoekt structuur op nanoschaal van dunne films
Studie onderzoekt structuur op nanoschaal van dunne films Afkoeling op hoge en middelhoge breedtegraden leidde tot verdroging in Noord-Afrika
Afkoeling op hoge en middelhoge breedtegraden leidde tot verdroging in Noord-Afrika Ontdekkingen van donkere materie kunnen licht werpen op nieuwe behandelingen voor ziekten
Ontdekkingen van donkere materie kunnen licht werpen op nieuwe behandelingen voor ziekten Apple verslapt grip op iPhone-reparatiewerkzaamheden
Apple verslapt grip op iPhone-reparatiewerkzaamheden Blootstelling aan nanodeeltjes kan slapende virussen in de longen doen ontwaken
Blootstelling aan nanodeeltjes kan slapende virussen in de longen doen ontwaken Wetenschappers kweken grafeen van hoge kwaliteit uit tea tree-extract
Wetenschappers kweken grafeen van hoge kwaliteit uit tea tree-extract
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

