
Wetenschap
Wetenschappers halen structuur van zalmvirus binnen
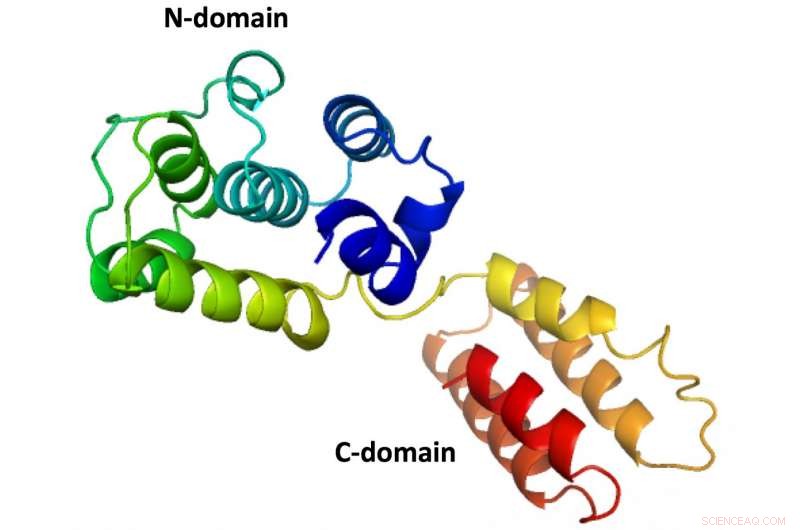
De eerste volledige structuur van een M1-eiwit van een infectieus zalmbloedarmoedevirus, zoals onthuld door wetenschappers van Rice University. De structuur van het eiwit, die een beschermend schild vormt rond de virale inhoud, vergelijkbaar is met die van influenzavirussen die mensen infecteren, maar er zijn geen structuren voor geproduceerd die zowel de N- als de C-domeinen vertonen. Krediet:Tao Laboratory/Rice University
De structuur van een eiwit dat de sleutel is tot het overleven en de verspreiding van een virus dat zalm aantast, zou kunnen bijdragen aan strategieën om de griep bij mensen te behandelen, volgens wetenschappers van Rice University.
Het Rice-lab van structureel bioloog Yizhi Jane Tao produceerde de eerste volledige structuur van het matrixeiwit dat wordt aangetroffen in een orthomyxovirus dat bloedarmoede veroorzaakt bij Atlantische zalm. Omdat de structuur en functie van het eiwit zo veel lijken op wat tot nu toe is gevonden in griepvirussen, Tao verwacht dat ze ook nuttig zullen zijn bij het bepalen van de mechanismen van menselijke virussen.
"Dit virus en alle griepvirussen behoren tot dezelfde familie, dus ze assembleren op een zeer vergelijkbare manier, "zei ze. "Hoewel dit eiwit afkomstig is van een vis-infecterend virus, het zal ons inzicht geven in hoe de matrixeiwitten de assemblage van andere virussen ondersteunen."
De ontdekking wordt deze maand gedetailleerd in de Proceedings van de National Academy of Sciences .
Tao's lab is gespecialiseerd in röntgenkristallografie en andere technieken om de basisstructuren van moleculen te onthullen, zoals het fragiele matrixeiwit genaamd M1. Veel pogingen om de volledige structuur te definiëren zijn mislukt omdat het eiwit twee hoofdsecties heeft:de N- en C-domeinen.
Omdat de dunne streng van residuen die de domeinen bij elkaar houdt zo gemakkelijk uit elkaar valt, onderzoekers hebben tot nu toe alleen N-domeinstructuren kunnen vangen door kristallisatie.

Een driedimensionale weergave van de structuur van het infectieuze zalmbloedarmoedevirus. De weergave laat zien, van boven, het paddenstoelvormige glycoproteïne, de buitenste membraanfolder, de binnenmembraanfolder en de matrixproteïneschil. Wetenschappers van Rice University hebben de volledige structuur verkregen van eiwitten die de binnenschaal vormen. Krediet:Tao Laboratory/Rice University
M1 kan op zichzelf kwetsbaar zijn, maar het wordt een harde schil wanneer het zich bindt met andere M1-eiwitten om een bolvormige of buisvormige matrix te vormen die het virale RNA inkapselt en beschermt. Deze matrix zit net binnen een lipide dubbellaag, de buitenste envelop van het virus die lange glycoproteïnen bevat. Deze glycoproteïnen zoeken en hechten aan doelcellen met hun ectodomeinen, terwijl hun cytoplasmatische staarten dienen als een brug naar het N-domein van het matrixeiwit. Het C-domein wijst naar binnen vanaf de matrix en is een brug naar de virale lading binnenin.
"M1 helpt de vorm te ondersteunen, " zei Tao. "Dat is een belangrijke functie voor elk matrixeiwit. De matrix helpt ook om het virale RNA op te nemen. Vermoedelijk, als er geen matrixeiwit is, je eindigt met een leeg blaasje."
De elleboogvormige structuur van de M1 die wordt aangetroffen in het infectieuze zalmbloedarmoedevirus heeft zes dicht opeengepakte alfa-helices die het N-domein vormen en sterk lijken op die gevonden in stammen van influenza A. Aan de andere kant van het flexibele scharnier, de elleboog, " ligt het C-domein met vier alfa-helices. Beide domeinen hebben hydrofobe kernen om ze te stabiliseren rond het scharnier dat tot wel 40 graden kan variëren.
Tao zei dat het hebben van de volledige structuur van het eiwit onderzoekers zal helpen bepalen hoe het en anderen zoals het polymeriseren tot een beschermende schaal en associëren met het membraan. "Als je de structuur van slechts één domein kent, we konden niet begrijpen hoe matrixeiwitten met elkaar interageerden om de schaal te vormen, " zei ze. "De interactie omvat beide domeinen."

Een cryo-elektrontomografiebeeld van het besmettelijke zalmbloedarmoedevirus toont details van zijn structuur, inclusief de binnenste matrix eiwitschil. Wetenschappers van Rice University hebben nu de volledige structuur verkregen van eiwitten die de binnenschaal vormen. Krediet:Tao Laboratory/Rice University
Ze zei dat de volledige structuur ook aanwijzingen zou kunnen geven voor toekomstige antivirale middelen tegen griep. Een behandeling die gericht is op M1 zou de met virus geïnfecteerde cellen moeten vinden en binnendringen.
"Maar als er een chemische stof is die de zelfassociatie van M1-eiwitten kan onderbreken, het zal erg handig zijn, " zei Tao. "Ik denk niet dat het uitmaakt welk domein het bindt, zolang het voorkomt dat de schaal zich vormt. Dit zou een geldig doelwit kunnen zijn."
 Studie versnelt de transformatie van biobrandstofafval in bruikbare chemicaliën
Studie versnelt de transformatie van biobrandstofafval in bruikbare chemicaliën Nieuw begrip van hoe cellen tunnels vormen, kan helpen bij het behandelen van wonden, tumoren
Nieuw begrip van hoe cellen tunnels vormen, kan helpen bij het behandelen van wonden, tumoren Röntgenexperimenten dragen bij aan studies van een medicijn dat nu is goedgekeurd om tuberculose te bestrijden
Röntgenexperimenten dragen bij aan studies van een medicijn dat nu is goedgekeurd om tuberculose te bestrijden Zouttolerante bacteriën met een honger naar slib maken biologisch afbreekbare kunststoffen
Zouttolerante bacteriën met een honger naar slib maken biologisch afbreekbare kunststoffen Nieuw materiaal kan ademhalingsdruppels uit de lucht verwijderen
Nieuw materiaal kan ademhalingsdruppels uit de lucht verwijderen
 Nieuw onderzoek geeft een betere kijk op de oceaanplaat onder Midden-Amerika
Nieuw onderzoek geeft een betere kijk op de oceaanplaat onder Midden-Amerika Studie vindt dat klimaat de vorm van stroomgebieden bepaalt
Studie vindt dat klimaat de vorm van stroomgebieden bepaalt De opvattingen over klimaatverandering veranderen, zelfs in Texas
De opvattingen over klimaatverandering veranderen, zelfs in Texas Terwijl de wetlands van Brazilië branden, regen is alleen maar hoop
Terwijl de wetlands van Brazilië branden, regen is alleen maar hoop Klimaattechniek:het modelleren van projecties simplificeert risico's
Klimaattechniek:het modelleren van projecties simplificeert risico's
Hoofdlijnen
- Onderzoekers testen probiotica in voeding en supplementen
- Elements of Nucleic Acids
- Wie geeft er om WA-uilen?
- Onderzoekers creëren 3D-celarrays voor meer realistische experimentele biologische omgevingen
- Hoe rouw werkt
- Wat zijn de verschillen van eenvoudig en gestratificeerd weefsel?
- Hogere biodiversiteit door rivierverruimende maatregelen
- Hoe een 3D-model van een plantencel te maken
- Besmettelijk geeuwen
- Diagnose van kunstacne in Georgia OKeeffes-schilderijen

- Bevordering van elektroreductie van stikstofmonoxide tot ammoniak via elektronenrijk Cu gemoduleerd door Ru-doping
- MRI-scanning helpt bij batterijontwerp van de volgende generatie

- Coronavirus-testkits worden ontwikkeld met behulp van nieuwe RNA-beeldvormingstechnologie

- Chemici versnelden de reactie van vinylsulfiden 10 keer
 Venetië onder water terwijl uitzonderlijk getij door kanaalstad raast
Venetië onder water terwijl uitzonderlijk getij door kanaalstad raast Database geeft details over schietpartijen en dodelijke incidenten door agenten
Database geeft details over schietpartijen en dodelijke incidenten door agenten Certificering van duurzame gewassen helpt mens en natuur, maar het zou meer kunnen doen om de armste boeren ter wereld te helpen
Certificering van duurzame gewassen helpt mens en natuur, maar het zou meer kunnen doen om de armste boeren ter wereld te helpen S. Korea gaat 25% van de kolencentrales opschorten om vervuiling te bestrijden
S. Korea gaat 25% van de kolencentrales opschorten om vervuiling te bestrijden Verhoging van de resolutie, weegschaal brengt CT-scanning en diagnose naar een hoger niveau
Verhoging van de resolutie, weegschaal brengt CT-scanning en diagnose naar een hoger niveau Gertrude Belle Elion
Gertrude Belle Elion  Eerste meercellige organisme inspireert het ontwerp van betere kankermedicijnen
Eerste meercellige organisme inspireert het ontwerp van betere kankermedicijnen Nieuw onderzoek om veilige locaties voor opslag van nucleair afval te helpen identificeren
Nieuw onderzoek om veilige locaties voor opslag van nucleair afval te helpen identificeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

