
Wetenschap
Gedetailleerd beeld van een moleculaire toxinetransporter
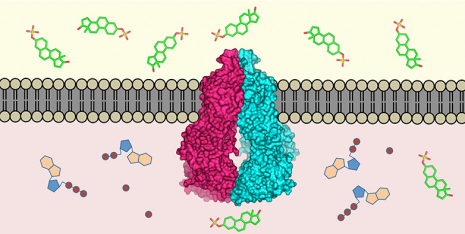
Het transporteiwit ABCG2 (midden) is ingebed in het celmembraan. Het herkent meer dan 200 stoffen in het celinterieur (onder) en transporteert ze naar buiten (boven). Krediet:ETH Zürich / Scott Jackson, Ioannis Manolaridis, Kaspar Locher
Transporteiwitten in de cellen van ons lichaam beschermen ons tegen bepaalde gifstoffen. Onderzoekers van ETH Zürich en de Universiteit van Basel hebben nu de driedimensionale structuur met hoge resolutie van een belangrijk menselijk transporteiwit bepaald. Op de lange termijn, dit zou kunnen helpen om nieuwe medicijnen te ontwikkelen.
Bijna alle levende wezens hebben mechanismen ontwikkeld om gifstoffen die hun cellen zijn binnengedrongen te verwijderen:moleculaire pompen in het celmembraan herkennen schadelijke stoffen in het celinterieur en transporteren ze naar buiten. Onderzoekers van ETH Zürich en het Biozentrum van de Universiteit van Basel hebben nu de driedimensionale structuur van zo'n transporteiwit bij de mens (het eiwit ABCG2) op atomair niveau gedefinieerd. Dit is de eerste keer dat een dergelijke structuur is gedefinieerd voor een menselijke multi-drugstransporter. De wetenschappers publiceerden hun werk in het laatste nummer van het wetenschappelijke tijdschrift Natuur .
"Het eiwit ABCG2 herkent en transporteert minstens 200 bekende stoffen, " legt Kaspar Locher uit, Hoogleraar Moleculaire Membraanbiologie aan de ETH Zürich en hoofd van de studie. Deze stoffen zijn onder meer alkaloïden – plantaardige stoffen die we via onze voeding binnenkrijgen – maar ook stoffen die door het lichaam zelf worden aangemaakt, zoals urinezuur of bilirubine (een metaboliet van hemoglobine).
Het eiwit is actief in de darmwand, bijvoorbeeld, waar het voorkomt dat schadelijke stoffen in het bloed komen; het wordt ook gevonden in de cellen van de bloed-hersenbarrière, waar het gifstoffen weghoudt van de hersenen. Eiwitten zoals ABCG2 spelen ook een belangrijke rol in de borstklieren en in de placenta, waar ze ervoor zorgen dat gifstoffen niet in de moedermelk of de bloedbaan van een ongeboren kind terechtkomen.
Tweesnijdend zwaard
De rol van multi-drug transporters heeft wel een keerzijde, echter:de eiwitten pompen ook sommige medicijnen uit cellen, voorkomen dat ze in die cellen werken. "Dit betekent dat bij het ontwikkelen van medicijnen, het is altijd belangrijk om te onderzoeken of ze worden herkend door transporteiwitten zoals ABCG2, " zegt Locher. Medicijnen die oraal worden toegediend, moeten de darmwand binnendringen, en die bedoeld voor de hersenen moeten de bloed-hersenbarrière passeren - wat ze alleen kunnen doen als ABCG2 ze niet herkent.
Het is bekend, echter, dat ABCG2 sommige kankermedicijnen (chemotherapeutica) herkent. Dit is bijzonder ernstig omdat bepaalde tumorcellen het aantal ABCG2-eiwitten in hun celmembranen kunnen verhogen. Dergelijke cellen pompen de chemotherapeutische stof efficiënt naar buiten, wat betekent dat ze resistent zijn tegen het medicijn.
Medicijnen ontwikkelen met computers
Nu wetenschappers de structuur van ABCG2 kennen, in de toekomst kunnen ze wellicht op een computer simuleren of nieuwe medicijnen door het transporteiwit worden herkend. Onderzoekers zouden computermodellering ook kunnen gebruiken om betere antilichamen te ontwikkelen voor de diagnose van resistente kankercellen, of medicijnen die het transporteiwit remmen. Dergelijke stoffen zouden kunnen helpen om weerstanden tegen bepaalde chemotherapeutica te overwinnen. "De bijdragen van ons onderzoek aan de geneeskunde, in het bijzonder kankermedicatie, moet echt op de langere termijn worden gezien. We bouwen vooral de fundamenten, " benadrukt Locher.
ABCG2 is een zeer mobiel molecuul, waardoor het moeilijk was om de atomaire structuur te bepalen. Door gebruik te maken van stabiliserende antilichamen, echter, de wetenschappers slaagden erin het eiwit te immobiliseren. De driedimensionale structuur werd bepaald met behulp van cryo-elektronenmicroscopie door de ETH-onderzoekers in samenwerking met Henning Stahlberg, een professor aan het Biozentrum van de Universiteit van Basel, en zijn groep. "We hebben de afgelopen tijd intensief gewerkt aan het optimaliseren van de resolutiecapaciteit van onze elektronenmicroscopen, en ze tegelijkertijd substantieel te automatiseren. Dit heeft nu geresulteerd in een ongelooflijk snelle pijplijn voor structuurbepaling, ', zegt Stahlberg.
Cryo-elektronenmicroscopie is een relatief nieuwe technologie voor het bepalen van atomaire moleculaire structuren. "Deze technologie heeft een revolutie teweeggebracht in de structurele biologie, " zegt Locher. Gezien het belang ervan, ETH Zürich zal blijven investeren in de methode en een tweede high-end cryo-elektronenmicroscoop aanschaffen voor het ScopeM-microscopiecentrum. Het zal beschikbaar zijn voor alle biowetenschappelijke onderzoekers om moleculen en structuren met atomaire resolutie te bestuderen.
 Is uw gezin CO-veilig wanneer grote stormen toeslaan?
Is uw gezin CO-veilig wanneer grote stormen toeslaan? Aardgas zorgt voor record CO2-uitstoot in 2019
Aardgas zorgt voor record CO2-uitstoot in 2019 Onderzoekers overwinnen uitdagingen om nieuwe tyfoonwaarnemingen te verzamelen
Onderzoekers overwinnen uitdagingen om nieuwe tyfoonwaarnemingen te verzamelen Metaalvervuiling in Britse wateren kan sint-jakobsschelpen bedreigen, studie onthult
Metaalvervuiling in Britse wateren kan sint-jakobsschelpen bedreigen, studie onthult Wateronderzoek ontdekt ontzilting van lokale stromen
Wateronderzoek ontdekt ontzilting van lokale stromen
Hoofdlijnen
- 25 nieuwe genomen om 25 jaar Sanger Institute te vieren
- Koud verbijsterde zeekoeien, zeeschildpadden opwarmen bij SeaWorld
- Welk vierkant is groter? Honingbijen zien visuele illusies zoals mensen dat doen
- Lokale elektrische reacties in bladeren maken fotosynthese hittetolerant
- Hoe hersenspoeling werkt
- Energiestroom (ecosysteem): definitie, proces en voorbeelden (met diagram)
- Veren hebben hun eigen geuren, en roofdieren weten het
- De vreemde empathie van plaatsvervangende schaamte
- Instructies voor het maken van een JELL-O Cell
- Nieuw polymeer wordt harder en verandert van kleur bij mechanische belasting
- Glow-in-the-dark papier als sneltest voor infectieziekten

- Op benzeen gebaseerde sondes markeren twee verborgen bindingsplaatsen op een doelwit tegen kanker
- Effect van menselijke activiteiten op het milieu

- Onderzoekers ontwikkelen met goud gecomplexeerde ferrocenylfosfines als krachtige antimalariamiddelen
 Misplaatste poging Californië om stedelijke dichtheid te forceren
Misplaatste poging Californië om stedelijke dichtheid te forceren Wat is een centrifugale aanjager?
Wat is een centrifugale aanjager?  Test voor het verminderen van suikers
Test voor het verminderen van suikers  Een verhaal over twee valleien:de regio's Latrobe en Hunter hebben beide kolenstations, maar men heeft veel ergere kwikvervuiling
Een verhaal over twee valleien:de regio's Latrobe en Hunter hebben beide kolenstations, maar men heeft veel ergere kwikvervuiling Zoekresultaten niet partijdig, Stanford studie vondsten
Zoekresultaten niet partijdig, Stanford studie vondsten Octupole hoektoestand in een driedimensionaal topologisch circuit
Octupole hoektoestand in een driedimensionaal topologisch circuit Natuurkundigen creëren stabiele, sterk gemagnetiseerde plasmastraal in laboratorium
Natuurkundigen creëren stabiele, sterk gemagnetiseerde plasmastraal in laboratorium Hoe zout van water te scheiden
Hoe zout van water te scheiden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

