
Wetenschap
Stille code van nucleotiden, geen aminozuren, bepaalt functies van vitale eiwitten
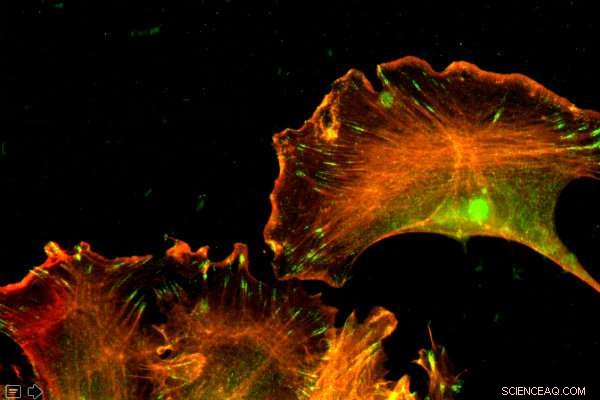
Actine is een overvloedig eiwit, aanwezig in elke cel. Penn Vet-onderzoekers toonden aan dat verschillen in de volgorde van nucleotiden - niet de aminozuren - de verschillende functies van twee vormen van actine regelden. Krediet:Universiteit van Pennsylvania
Mensen bezitten zes vormen van het eiwit actine, die essentiële functies in het lichaam vervullen. Twee in het bijzonder, -actine en γ-actine, zijn bijna identiek, slechts vier aminozuren van elkaar verschillen. Toch vervullen deze bijna-tweelingeiwitten verschillende rollen. Een al lang bestaande vraag voor biologen is:hoe is dit mogelijk?
"Het is een mysterie waarover de afgelopen 40 jaar in het veld wordt gedebatteerd, " zei Anna Kashina, een professor in de biochemie aan de University of Pennsylvania School of Veterinary Medicine.
Nieuwe bevindingen van Kashina en collega's hebben op een verrassend antwoord gewezen. De verschillende functies van deze eiwitten worden niet bepaald door hun aminozuursequenties, maar door hun genetische code.
"We noemen het graag de 'stille code, '" zei Kashina. "Onze bevindingen tonen aan dat de delen van genen waarvan we denken dat ze stil zijn, eigenlijk zeer belangrijke functionele informatie coderen."
De onderzoekers ontdekten dat deze "stille" verschillen in de nucleotidesequentie de dichtheid van ribosomen lijken te beïnvloeden, de moleculaire machines die RNA vertalen in eiwitten. Dergelijke verschillen kunnen het mogelijk maken dat elke individuele actinevorm een andere rol in de cel op zich neemt.
Kashina was co-auteur van het werk, gepubliceerd in het tijdschrift eLife , met Pavan Vedula van Penn Vet, Satoshi Kurosaka, Nicolae Adrian Leu, Junling Wang, Stephanie Sterling en Dawei Dong en Yuri I. Wolf en Svetlana A. Shabalina van de National Institutes of Health.
Actine is zo alomtegenwoordig en essentieel dat het bekend staat als een 'huishoudelijk eiwit'. Het is het meest voorkomende eiwit in de meeste cellen, en zijn verschillende vormen spelen een rol tijdens celmigratie, spiercontractie en ontwikkeling. Voor een tijdje, wetenschappers dachten dat de verschillende vormen functioneel overbodig waren, alleen bestaand om als back-up te dienen in het geval één formulier een defect had.
Recenter, onderzoekers zijn gaan begrijpen dat de formulieren niet overbodig zijn; sommige lokaliseren naar verschillende delen van de cellen, sommige zijn opgenomen in verschillende delen van het cytoskelet. En als er met deze eiwitten geknoeid wordt, de uitkomsten zijn ook anders.
Wanneer β-actine ontbreekt, bijvoorbeeld, muizen sterven in een vroeg stadium van de embryonale ontwikkeling. Maar muizen zonder γ-actine, hoewel meestal kleiner dan normaal en doof, kan overleven tot in de volwassenheid.
In een rapport uit 2010 in Science, De groep van Kashina heeft een stap gezet om inzicht te krijgen in wat deze verschillen bepaalt. Kijkend naar een eiwitmodificatie die normaal alleen bestaat in β-actine, ze ontdekten dat de reden dat het niet ook aanwezig was op γ-actine te wijten was aan variaties in de coderende sequentie tussen de twee actine-genen.
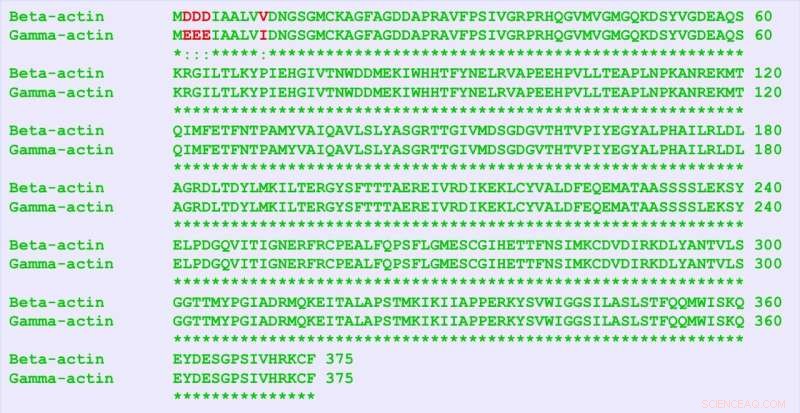
β-actine en γ-actine zijn bijna identieke eiwitten, slechts vier aminozuren verschillen (in rood). Maar ze bevatten veel meer verschillen in hun nucleotidesequentie, en deze "stille code" is verantwoordelijk voor verschillende functies van de twee eiwitten, vonden de onderzoekers. Krediet:Universiteit van Pennsylvania
“Hier wilden we op voortbouwen, " zei Kashin, "en besloot de hypothese te testen, 'Wat als hun functionele verschillen niets te maken hadden met hun aminozuurvolgorde; wat als het allemaal in de genen zit?'"
De onderzoekers maakten gebruik van de precisie-genbewerking die mogelijk werd gemaakt door het CRISPR/Cas-9-systeem. Hoewel de twee actine-isovormen slechts vier aminozuren verschillen, hun mRNA-coderende sequenties verschillen met bijna 13 procent vanwege "stille" nucleotideverschillen die niettemin voor dezelfde aminozuren coderen. Wijzigingen aanbrengen in slechts vijf nucleotiden in het β-actine-gen, ze waren in staat om het te transformeren zodat de aminozuuroutput precies hetzelfde zou zijn als het γ-actine-eiwit. Het enige dat het zou onderscheiden, zouden de stille nucleotidesubstituties zijn.
De gen-editing werkte. Muizen met deze bewerkingen hadden geen β-actine-eiwit. Maar in tegenstelling tot echte β-actine-knockouts waren ze volledig gezond en levensvatbaar, net alsof ze de juiste verhoudingen van β-actine- en γ-actine-eiwitten bezaten. Ze overleefden om zich voort te planten en hadden gemiddeld dezelfde worpgroottes als normale dieren.
De onderzoekers voerden hetzelfde experiment uit, het bewerken van het γ-actine-gen om te coderen voor het β-actine-eiwit, maar waren alleen in staat om de coderende sequentie voor drie van de vier aminozuren te veranderen. Nog altijd, muizen die aan deze gedeeltelijke vervanging waren onderworpen, leken ook normaal en gezond, ondanks het ontbreken van γ-actine-eiwit.
Bij vervolgexperimenten Het team van Kashina ontdekte dat de γ-actine-eiwitten gemaakt van het bewerkte β-actine-gen een normaal cytoskelet vormden en de cel in staat stelden op een normale manier te migreren.
"Als alleen de nucleotidesequentie belangrijk is voor de eiwitfunctie, dan zou het de muizen niet uit moeten maken welk eiwit ze hebben, ' zei Kashina. 'En het kon de muizen niets schelen.'
Om tot een mechanisme te komen voor hoe de DNA-sequentie de eiwitfunctie zou kunnen beïnvloeden, de onderzoekers ontdekten dat de dichtheid van ribosomen op -actine-RNA meer dan duizend keer hoger is dan op γ-actine-RNA, en inderdaad hadden alle zes actinegenen verschillen in ribosoomdichtheid.
"Dit suggereert dat β-actine zich misschien duizend keer sneller in eiwit zou kunnen vertalen dan γ-actine, ' zei Kashin.
En nieuwsgierig naar hoe wijdverbreid dit fenomeen zou kunnen zijn, de onderzoekers zochten naar eiwitfamilies met bijna identieke leden die worden gecodeerd door verschillende genen en hadden significante variaties in ribosoomdichtheid in de familie. Ze vonden veel groepen die werden gedeeld door muizen, zebravissen en menselijke genomen.
"We denken dat deze vorm van functionele regulering een wereldwijd fenomeen is, " zei Kashin, en het is er een die haar lab zal blijven onderzoeken.
 Chemici ontdekken een nieuw vormingsmechanisme van stoffen tegen kanker
Chemici ontdekken een nieuw vormingsmechanisme van stoffen tegen kanker Oppervlakte-effect van elektroden onthuld door operando oppervlaktewetenschapsmethodologie
Oppervlakte-effect van elektroden onthuld door operando oppervlaktewetenschapsmethodologie Onderzoekers vereenvoudigen en stroomlijnen de organische chemische synthese drastisch
Onderzoekers vereenvoudigen en stroomlijnen de organische chemische synthese drastisch Hoe maak je kristallen sneller groeien
Hoe maak je kristallen sneller groeien  Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
 Saoedi-Arabië wordt geconfronteerd met toenemende hitte, vochtigheid, extreme neerslag tegen het midden van de eeuw
Saoedi-Arabië wordt geconfronteerd met toenemende hitte, vochtigheid, extreme neerslag tegen het midden van de eeuw Onderzoekers vinden nieuwe manier om magma onder de supervulkaan Yellowstone te schatten
Onderzoekers vinden nieuwe manier om magma onder de supervulkaan Yellowstone te schatten Verwachte afname van het zee-ijs in de winter in het Noordpoolgebied gekoppeld aan de Euraziatische circulatie
Verwachte afname van het zee-ijs in de winter in het Noordpoolgebied gekoppeld aan de Euraziatische circulatie Nieuw begrip van oceaanturbulentie kan klimaatmodellen verbeteren
Nieuw begrip van oceaanturbulentie kan klimaatmodellen verbeteren Het bereiken van gezond, klimaatvriendelijk, betaalbare diëten in India
Het bereiken van gezond, klimaatvriendelijk, betaalbare diëten in India
Hoofdlijnen
- Maak een lijst van de 3 stappen die zich voordoen tijdens de interfase
- Waarom maken we verkeerde keuzes?
- Wat doet de temporale kwab?
- Studie kan strategieën opleveren om het goede cholesterol te verhogen
- Episch taaie baobabbomen sterven af in Afrika
- Hoe slaapwandelen werkt
- Wat doen onze lichaamscellen met zuurstof?
- Vrouwelijke wetenschappers die de wereld veranderden
- Wat zijn de voor- en nadelen van flowcytometrie?
 Oceanografen lossen mysterie van overleving van fytoplankton op in voedselarme Stille Oceaan
Oceanografen lossen mysterie van overleving van fytoplankton op in voedselarme Stille Oceaan Hoe de spieren van het menselijk lichaam te onthouden
Hoe de spieren van het menselijk lichaam te onthouden  Nieuwe radiotelescoop in Brookhaven ziet de ruimte in een ander licht
Nieuwe radiotelescoop in Brookhaven ziet de ruimte in een ander licht NASA selecteert voorstellen voor nieuwe ruimtemissies
NASA selecteert voorstellen voor nieuwe ruimtemissies Handgetekende kaarten imiteerden de gedrukte kaarten in de eerste dagen van de Spaans-Amerikaanse cartografie
Handgetekende kaarten imiteerden de gedrukte kaarten in de eerste dagen van de Spaans-Amerikaanse cartografie Het produceren van kunstmest uit lucht zou vijf keer zo efficiënt kunnen zijn
Het produceren van kunstmest uit lucht zou vijf keer zo efficiënt kunnen zijn Bio-geïnspireerde vormen laten groeien met honderden kleine robots
Bio-geïnspireerde vormen laten groeien met honderden kleine robots Wetenschappers ontdekken dat röntgenstralen omkeerbare weerstandsveranderingen kunnen veroorzaken
Wetenschappers ontdekken dat röntgenstralen omkeerbare weerstandsveranderingen kunnen veroorzaken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com






