
Wetenschap
Onderzoekers verduidelijken hoe cellen zichzelf verdedigen tegen virussen
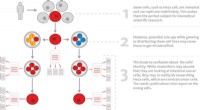
Het vermogen om onderscheid te maken tussen cellulair RNA en viraal RNA – een proces dat zelf-niet-zelfdiscriminatie wordt genoemd – is van fundamenteel belang voor de aangeboren immuunrespons van alle dieren. Wanneer virussen cellen infecteren, repliceren ze zich in de gastheercel, en dit proces genereert dubbelstrengs viraal RNA (dat van nature niet in de cel voorkomt) als tussenproduct.
Bij mensen en andere gewervelde dieren wordt de aanwezigheid van deze niet-eigen RNA-moleculen doorgaans gedetecteerd door een eiwit genaamd MDA5, een cytoplasmatische RNA-sensor. MDA5 initieert de productie van antivirale eiwitten die de infectie beperken.
In deze studie, gepubliceerd in Nature Structural and Molecular Biology, geven de Crick-onderzoekers een gedetailleerd inzicht in de eerste stappen van dit cruciale verdedigingsmechanisme. De onderzoekers verkregen 3D-structuren van MDA5 gebonden aan dubbelstrengs RNA, waardoor ze precies konden vaststellen hoe het sensoreiwit het virale RNA herkent en de cellulaire antivirale respons initieert.
Uit de structuren bleek dat MDA5 geen onderscheid maakt tussen zelf- en niet-zelf-RNA-sequenties, maar dat ze onderscheid maken op basis van de vorm. Terwijl cellulair RNA een continue helix vormt, heeft viraal RNA een knik in het midden, waardoor een specifieke bindingsplaats voor MDA5 bloot komt te liggen.
Een fundamenteel immuunmechanisme
“MDA5 is een van de belangrijkste sensoren in het aangeboren immuunsysteem en is essentieel voor antivirale immuniteit. Daarom levert het begrijpen van hoe het werkt tot in zulke ingewikkelde details significante inzichten op in de manier waarop ons lichaam virale infecties bestrijdt”, legt hoofdauteur Dr. Carlos R. Ortiz-Caravaca, groepsleider in RNA Biology bij de Crick, uit.
Om de 3D-structuren van MDA5 met RNA te verkrijgen, gebruikten de onderzoekers een techniek genaamd cryo-elektronenmicroscopie, gecombineerd met biochemische testen om vast te stellen hoe MDA5 onderscheid maakt tussen zelf- en niet-zelf-RNA's.
In de cryo-elektronenmicroscopie werden de structuren bepaald met een resolutie van 3,4 Å (Ångströms), waardoor de onderzoekers de individuele atomen van de RNA-helices en de eiwitplooien zichtbaar konden maken.
Door precies te begrijpen hoe MDA5 dubbelstrengig viraal RNA herkent en antivirale afweer in gang zet, kunnen de onderzoekers nu proberen nieuwe behandelingen te ontwikkelen voor virale infecties, waaronder opkomende virussen zoals SARS-CoV-2 en MERS-CoV.
“Bij sommige virale infecties, zoals griep, is het lichaam erg goed in het genereren van een effectieve antivirale reactie tegen de infectie. Door een gedetailleerd inzicht te krijgen in hoe dit proces plaatsvindt, kunnen we die kennis gebruiken om de immuunrespons van het lichaam op virale infecties waarvoor we geen effectieve verdediging hebben te verbeteren”, zegt Dr. Ortiz-Caravaca.
Onthulling van de details
Het team merkte op dat MDA5 twee RNA-bindende domeinen bevat:het ene domein is verantwoordelijk voor het ‘voelen’ van het RNA, terwijl het andere verantwoordelijk is voor de signalering om de antivirale respons te activeren.
Bij virale infectie vindt het sensordomein het virale dubbelstrengige RNA en bindt zich eraan. Deze bindingsgebeurtenis veroorzaakt een conformationele verandering die het signaaldomein blootlegt, waardoor het eiwit het signaal kan doorgeven en de antivirale respons kan activeren.
MDA5 maakt deel uit van een bredere groep RNA-sensoreiwitten die allemaal betrokken zijn bij de verdediging tegen virussen. De onderzoekers hopen dezelfde technieken toe te passen om te begrijpen hoe andere sensoren werken, en op deze manier een uitgebreid beeld te krijgen van de verschillende manieren waarop cellen virussen onderscheiden en zichzelf tegen infecties beschermen.
***
Het Francis Crick Institute is een biomedisch onderzoeksinstituut dat zich toelegt op het begrijpen van de fundamentele biologie die ten grondslag ligt aan gezondheid en ziekte. De onderzoekers pakken de grootste vragen in de biologie aan door middel van experimentele wetenschap en interdisciplinaire samenwerking, en de wetenschappelijke doorbraken helpen onderzoek te vertalen naar behandelingen voor patiënten.
The Crick werd opgericht in 2015 en is gevestigd in Londen, VK. The Crick is een samenwerkingsverband tussen zes organisaties:het Medical Research Council Laboratory of Molecular Biology, Cancer Research UK, het Wellcome Sanger Institute, University College London, Imperial College London en King’s College London.
***
Contact
Laura Marr, communicatiemedewerker
laura.marr@crick.ac.uk
07919 923366
Wetenschappelijk contact
Dr Carlos R. Ortiz-Caravaca
Groepsleider in RNA-biologie, het Francis Crick Institute
carlos.ortiz-caravaca@crick.ac.uk
 Hoe verleng je de levensduur van smeermiddelen?
Hoe verleng je de levensduur van smeermiddelen? Vliegen injecteren met slakkengif kan ons helpen moleculen te ontdekken voor het ontwikkelen van nieuwe medicijnen
Vliegen injecteren met slakkengif kan ons helpen moleculen te ontdekken voor het ontwikkelen van nieuwe medicijnen Efficiëntere scheiding van methaan en CO2
Efficiëntere scheiding van methaan en CO2 Onderzoekers sporen nieuwe biokatalysatoren op
Onderzoekers sporen nieuwe biokatalysatoren op Wetenschappers bakken glutenvrij brood met een revolutionaire technologie
Wetenschappers bakken glutenvrij brood met een revolutionaire technologie
 Problemen waarmee de atmosfeer van de aarde wordt geconfronteerd
Problemen waarmee de atmosfeer van de aarde wordt geconfronteerd  CryoSat verovert ijs op Arctische meren
CryoSat verovert ijs op Arctische meren Microplastics hopen zich op in hotspots voor diepzeeleven
Microplastics hopen zich op in hotspots voor diepzeeleven Laat kommer en kwel vallen:klimaatjournalistiek gaat over empowerment
Laat kommer en kwel vallen:klimaatjournalistiek gaat over empowerment Oude handgrepen van potten bieden een overzicht van de magnetische veldsterkte van de aarde in de loop van de tijd
Oude handgrepen van potten bieden een overzicht van de magnetische veldsterkte van de aarde in de loop van de tijd
Hoofdlijnen
- Het verschil tussen histon en nonhistone
- Hoe libellenvleugels hun patronen krijgen
- Verloren of uitgestorven? Onderzoek wijst uit dat het bestaan van meer dan 500 diersoorten onzeker blijft
- Deoxyribonucleïnezuur (DNA): structuur, functie en belang
- Suiker in babyvoeding:waarom Nestlé rekening moet houden Afrika
- Zoete aardappelgenetica:een uitgebreide update van de Taizhong 6-genoomannotatie
- Onderzoekers ontdekken dat stress tijdens de zwangerschap de grootte van de baby beïnvloedt
- Opnieuw beoordelen wat we van peptiden kunnen verwachten bij de detectie van ziekten
- Wat doodt de kleinste uilen van Australië?
- Reusachtige 200 jaar oude cactus omgevallen door hevige regen in de VS

- Hoe hoog kan een boom worden?

- Eiwit beperkt de opname van sap door bladluizen

- Ouderleeftijd kan een belangrijke factor zijn om volbloedpaarden als eerste voorbij de post te helpen

- De geesten van HeLa:hoe verkeerde identificatie van cellijnen de wetenschappelijke literatuur besmet
 Hoe volumes van vijfhoekige prisma's te berekenen
Hoe volumes van vijfhoekige prisma's te berekenen Veelbelovende nieuwe techniek brengt de microscopische details van de hersenen scherper in beeld
Veelbelovende nieuwe techniek brengt de microscopische details van de hersenen scherper in beeld Winst TAP Air Portugal stijgt na jaren in het rood
Winst TAP Air Portugal stijgt na jaren in het rood NASA daagt K-12-studenten uit om maangravende robots te ontwerpen
NASA daagt K-12-studenten uit om maangravende robots te ontwerpen Glasvezel legt seismische handtekeningen van de rozenparade vast
Glasvezel legt seismische handtekeningen van de rozenparade vast De winning van fossiele brandstoffen beperken om de opwarming van de aarde onder de 1,5°C-doelstelling te houden
De winning van fossiele brandstoffen beperken om de opwarming van de aarde onder de 1,5°C-doelstelling te houden Meer kinderen in gezinnen met meerdere generaties
Meer kinderen in gezinnen met meerdere generaties Nauwe verbinding tussen diepe stromingen en klimaat
Nauwe verbinding tussen diepe stromingen en klimaat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

