
Wetenschap
Als ribosomen botsen:hoe bacteriën opruimen na moleculaire crashes
Tegoed:CC0 Publiek Domein
De knobbelige, 3D-structuur op het scherm voor Rachel Green toonde een intracellulair autowrak dat nog nooit eerder door wetenschappers was gezien. Het bevestigde ook een hypothese waar een team in haar lab al maanden aan werkte.
Maar in het begin was Green niet zo onder de indruk. "Dat is het?" ze herinnert zich dat ze wrang dacht.
Het was begin 2021 en ze was op sabbatical en werkte aan de Ludwig Maximilian Universiteit van München met haar vriend en medewerker, Roland Beckmann. Green, een Howard Hughes Medical Institute-onderzoeker aan de Johns Hopkins University, had hem verteld over een project in haar laboratorium dat een al lang bestaand biologisch mysterie onderzoekt. Ze probeerden een belangrijke leemte op te vullen in de kennis van wetenschappers over hoe bacteriële cellen reageren op problemen met eiwitsynthese. Omdat cellen eiwitten nodig hebben voor bijna alles wat ze doen, is deze reactie van cruciaal belang voor een normale functie.
Het team van Green had een goed idee van wat er aan de hand was, maar ze hadden niet de snapshots om het te bewijzen. Beckmann, een structureel bioloog, was geïntrigeerd. Met behulp van een techniek die cryo-elektronenmicroscopie wordt genoemd, onthulde zijn team wat er ter plaatse gebeurt, dat wil zeggen, als je wist waar je op moest letten.
"Als ze je voor het eerst een structuur laten zien, kun je niet echt zien wat iets is, omdat alles grijs is", zegt Green. "Roland wees naar een kleine klodder en zei:'Kijk, daar is het!'"
Haar team vermoedde dat de "kleine klodder" fungeerde als een moleculaire eerstehulpverlener die opduikt bij het ongeval. De beelden van Beckmann bevestigden de identiteit van het molecuul en presenteerden nieuwe informatie over hoe deze reddingsoperatie, een methode voor kwaliteitscontrole van bacteriën, werkt. Beckmann, Green en een groep wetenschappers in haar lab onder leiding van Allen Buskirk beschreven het onderzoek eerst in een preprint op bioRxiv.org en later in het tijdschrift Nature op 9 maart 2022. Het werk zou aanwijzingen kunnen bieden over hoe andere, meer complexe organismen - misschien zelfs mensen - de eiwitproductie op het goede spoor houden.
Moleculaire machines die bekend staan als ribosomen volgen letterlijk instructies die zijn gecodeerd in een lineaire streng genetisch materiaal. Terwijl ze langs de streng reizen, bouwen ze een eiwit op. Soms werkt deze machine echter niet goed.
Eerder onderzoek in gist, waarvan de cellen lijken op die van dieren, had aangetoond dat ribosomen afhaken als ze in de problemen komen. Net als een auto die te plotseling stopt, kan een vastgelopen ribosoom van achteren worden gereden door degene die erachter zit. Green's lab had eerder een gistmolecuul geïdentificeerd dat op deze botsingen reageert. Als een kleine levenskaak snijdt het molecuul het vastgelopen ribosoom los. Het is de eerste stap in een reddingsoperatie die de cel uiteindelijk in staat stelt deze waardevolle, eiwitproducerende machines te redden en opnieuw te gebruiken.
De ribosomen van bacteriële cellen kunnen ook vastlopen, maar wetenschappers betwijfelen of bacteriën op dezelfde manier reageren op botsingen als gist. Dat komt omdat onderzoekers al wisten dat bacteriën hun eigen specifieke methode hebben om vernielde ribosomen te redden, zegt Jamie Cate, een biochemicus en structureel bioloog aan de University of California, Berkeley, die niet bij het project betrokken was.
Niemand wist precies wat de start was van de bacteriële reddingsoperatie, maar ze verwachtten dat het iets heel anders zou zijn dan gist, zegt Cate. In plaats daarvan suggereert het nieuwe onderzoek dat zowel bacteriën als gisten dit proces op dezelfde manier initiëren:door mesachtige eerstehulpverleners op te roepen.
"Het leuke is dat beide moleculen ribosomen herkennen die tegen elkaar zijn gebotst", zegt Cate.
In het laboratorium van Green in Baltimore identificeerden Buskirk en eerste auteur Kazuki Saito de eerste responder in bacteriën als een molecuul genaamd SmrB en onderzochten hoe het zijn werk uitvoerde. De structuur van Beckmann "was het laatste stukje van de puzzel", zegt Buskirk.
De groep van Beckmann maakte de allereerste beelden van een botsing tussen twee bacteriële ribosomen en gaf ze vervolgens een kleurcode zodat hun componenten niet verloren gingen in een zee van grijs. Na het toevoegen van SmrB aan het monster met de ribosomen, zag het team het molecuul verschijnen in het midden van de crash.
Biochemische experimenten onthulden dat SmrB, net als zijn gist-tegenhanger, de vernielde ribosomen uit elkaar snijdt. En niet alleen delen de twee moleculen een taakomschrijving, bacteriële SmrB en zijn gist-tegenhanger zijn ook nauwe verwanten, ontdekte het team. Onderzoekers hebben nog niet kunnen visualiseren hoe de gistversie interageert met ribosomen tijdens een botsing. Dus de vergelijkbare maar eenvoudigere SmrB kan wetenschappers een houvast geven om te begrijpen hoe het proces in andere organismen werkt.
"Al het andere aan deze reddingsroutes is heel anders", zegt Green. "We hadden niet verwacht dat we een aspect zouden vinden dat universeel lijkt te zijn."
 Eigenschappen van katalysatoren bestudeerd met gammastraalresonantie
Eigenschappen van katalysatoren bestudeerd met gammastraalresonantie Tandemkatalysator om de elektroreductie van kooldioxide tot methaan te verbeteren
Tandemkatalysator om de elektroreductie van kooldioxide tot methaan te verbeteren Onderzoekers maken een magneet gemaakt van één molecuul
Onderzoekers maken een magneet gemaakt van één molecuul Speeksel- en bacterie-experimenten voor een Science Fair-project
Speeksel- en bacterie-experimenten voor een Science Fair-project  Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie
Onderzoekers lossen een materiaalmysterie op voor elektronische apparaten van de volgende generatie
 Hoe kunnen delen van Canada de zwaartekracht missen?
Hoe kunnen delen van Canada de zwaartekracht missen?  Biologen kwantificeren het koolstofverbruik van bacterioplankton om de koolstofcyclus van de oceaan beter te begrijpen
Biologen kwantificeren het koolstofverbruik van bacterioplankton om de koolstofcyclus van de oceaan beter te begrijpen Onderzoek toont aan wanneer de bevolkingsdruk toeneemt, voedsel wordt geïmporteerd
Onderzoek toont aan wanneer de bevolkingsdruk toeneemt, voedsel wordt geïmporteerd Hoe beïnvloedt klimaatverandering oceaanwateren en ecosystemen?
Hoe beïnvloedt klimaatverandering oceaanwateren en ecosystemen? Soorten bomen, gras en struiken in de savanne
Soorten bomen, gras en struiken in de savanne
Hoofdlijnen
- Chromosomale afwijkingen: wat is het?, Typen en oorzaken
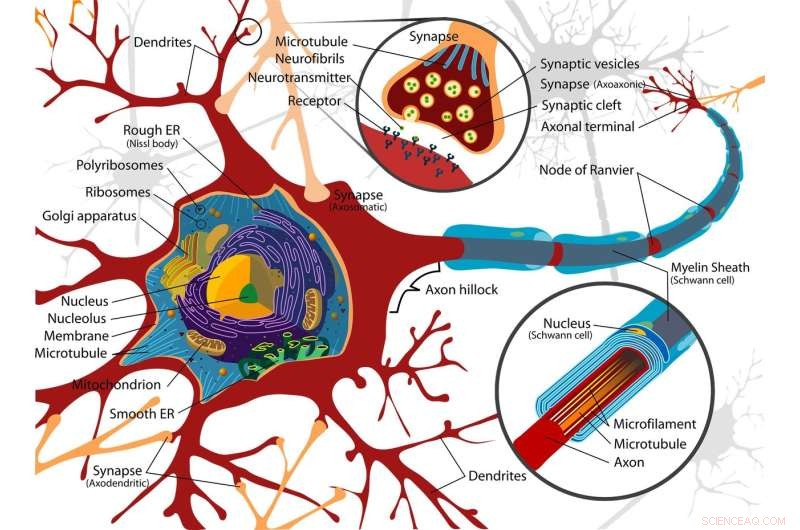
- Wat is de elektrische impuls die een Axon naar beneden beweegt?
- Persoonlijkheids- en stemmingswisselingen bij bacteriën
- Wetenschappers voltooien conserveringspuzzel, begrip van het leven op aarde vormen
- Extra smaak- en fraudepreventie op het menu voor de Europese bier- en wijnindustrie
- Coeliakie-vriendelijke ontbijtgranen? Onderzoek toont aan dat haver het antwoord kan zijn
- 25 nieuwe genomen om 25 jaar Sanger Institute te vieren
- Vogelherkenning
- De Krebs-cyclus en de Homeostasis
- Hoe nieuwe vogelsoorten ontstaan

- Hoe een tRNA-reeks te krijgen van een DNA-reeks
- Hoe jaloezie werkt

- Dieren zijn geëvolueerd om overexploitatie van hun hulpbronnen te voorkomen. Kunnen mensen hetzelfde doen?

- Kune Kune-biggen beschikken over sociale leervaardigheden en hebben een verbazingwekkend goed geheugen

 Voorbeelden van reële waarschijnlijkheid
Voorbeelden van reële waarschijnlijkheid  Ex-Nissan-chef Ghosn aangeklaagd, geserveerd met een nieuw arrestatiebevel
Ex-Nissan-chef Ghosn aangeklaagd, geserveerd met een nieuw arrestatiebevel Onderzoekers gebruiken supercomputer om inzicht te krijgen in hepatitis B
Onderzoekers gebruiken supercomputer om inzicht te krijgen in hepatitis B De tools maken om isiXhosa en isiZulu te verbinden met het digitale tijdperk
De tools maken om isiXhosa en isiZulu te verbinden met het digitale tijdperk Arseen in huishoudelijk bronwater kan twee miljoen mensen in de VS treffen
Arseen in huishoudelijk bronwater kan twee miljoen mensen in de VS treffen Onderzoekers passen ionenzachte landingstechniek toe voor vooruitgang in materiaalsynthese
Onderzoekers passen ionenzachte landingstechniek toe voor vooruitgang in materiaalsynthese EPA reguleert twee giftige chemicaliën in drinkwater
EPA reguleert twee giftige chemicaliën in drinkwater Ouders, zou je je kind zelf een Uber of Lyft laten rijden?
Ouders, zou je je kind zelf een Uber of Lyft laten rijden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

