
Wetenschap
Hoe een eiwit vrijkomt om dodelijke kankers te veroorzaken
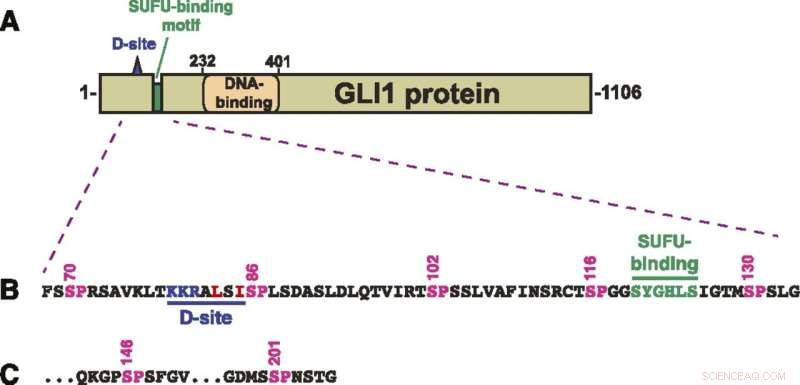
Structuur van GLI1-eiwit. (A) Schematische voorstelling van de primaire structuur van menselijk GLI1-eiwit, met de MAPK-docking-site (D-site), het SUFU-bindende motief en het zinkvinger-DNA-bindende domein. Het transcriptionele activeringsdomein vormt een groot deel van de C-terminale helft van het eiwit. (B) Aminozuursequentie van residuen 68-134, met de D-site, het SUFU-bindende motief en een cluster van vijf canonieke MAPK-fosforylatieplaatsen (SP). De bovenstaande cijfers tonen de positie van de serineresiduen in de SP-plaatsen. (C) De laatste twee van de zeven SP MAPK-fosforylatieplaatsen in residuen van 68-232 GLI1. Na S201 vindt de volgende SP- of TP-site plaats op S441. Krediet:A. Jane Bardwell et al, Life Science Alliance (2022). DOI:10.26508/lsa.202101353
Betere behandelingen voor sommige van de dodelijkste vormen van kanker zouden dichterbij kunnen komen dankzij een door de Universiteit van Californië, Irvine geleide ontdekking over hoe een bepaald eiwit wordt geactiveerd in tumorcellen. De bevinding, aangevoerd door onderzoekers van de School of Biological Sciences, zou uiteindelijk kunnen leiden tot mogelijke therapieën voor het bijzonder gevaarlijke melanoom en pancreasadenocarcinoom, evenals het meest voorkomende type hersenkanker bij kinderen en huidkanker bij volwassenen. Een paper waarin het project wordt beschreven, verschijnt in Life Science Alliance .
De ontdekking heeft betrekking op het GLI1-eiwit, dat belangrijk is bij de celontwikkeling, maar ook bij verschillende kankers is ingeschakeld. GLI1 wordt meestal geactiveerd door de Hedgehog-signaleringsroute, bekend als HH. Wetenschappers weten echter al ongeveer tien jaar dat overspraak (interactie) tussen HH en de door mitogeen geactiveerde proteïnekinaseroute een rol speelt bij kankers.
"In sommige gevallen kunnen eiwitten in de ene route eiwitten in een andere aanzetten", zegt hoofdauteur A. Jane Bardwell, projectwetenschapper bij de afdeling Ontwikkelings- en celbiologie van de UCI. "Het is een complex systeem. We wilden het moleculaire mechanisme begrijpen dat ertoe leidt dat GLI1 wordt geactiveerd door eiwitten in de MAPK-route."
GLI1 bindt normaal gesproken stevig aan een eiwit dat SUFU wordt genoemd. Dat eiwit onderdrukt GLI1, waardoor het de celkernen niet kan binnendringen en genen kan aanzetten. De wetenschappers onderzochten zeven plaatsen op het GLI1-eiwit die gefosforyleerd konden worden of waarop een fosfaatgroep kon worden overgebracht.
"We hebben er drie geïdentificeerd die kunnen worden gefosforyleerd en die betrokken zijn bij het verzwakken van de binding tussen GLI1 en SUFU", zegt Lee Bardwell, hoogleraar ontwikkelings- en celbiologie, wiens laboratorium het project uitvoerde. "Dit proces activeert GLI1, waardoor het de celkern kan binnendringen, waar het ongecontroleerde groei kan veroorzaken, resulterend in kanker."
Hij merkte op dat fosforylering van alle drie de locaties een significant hoger niveau van GLI1-ontsnapping uit SUFU veroorzaakt dan wanneer slechts één of zelfs twee fosfaatgroepen ontvangen.
De ontdekking is een belangrijke stap in de richting van effectievere en gepersonaliseerde kankerbehandelingen. "Als we precies kunnen begrijpen wat er gaande is in een bepaalde kanker of bepaalde tumor, zou het mogelijk kunnen zijn om een medicijn te ontwikkelen dat specifiek is voor een specifieke tumor of individuele patiënt," zei Bardwell. "Het zou ons in staat stellen om deze ziekten te behandelen zonder de toxiciteit van basale chemotherapie." Bovendien hebben veel tumoren van dezelfde kanker verschillende mutaties tussen individuen. Uiteindelijk kan het haalbaar zijn om tumoren te screenen om voor elk de beste aanpak te ontwikkelen.
Het onderzoek werd uitgevoerd in samenwerking met de afdeling Microbiologie &Moleculaire Genetica van de UCI School of Medicine en de afdeling Dermatologie van de Stanford University School of Medicine.
 Onderzoeksteam streeft ernaar de kosten van medicijnontwikkeling te verlagen met behulp van 3D-geprinte levende weefsels
Onderzoeksteam streeft ernaar de kosten van medicijnontwikkeling te verlagen met behulp van 3D-geprinte levende weefsels Nieuwe therapeutische strategie tegen slaapziekte
Nieuwe therapeutische strategie tegen slaapziekte Landen die Celsius gebruiken
Landen die Celsius gebruiken  Wetenschapsprojecten met Crayons
Wetenschapsprojecten met Crayons Nieuwe sensortechnologie maakt supergevoelige live monitoring van menselijke biomoleculen mogelijk
Nieuwe sensortechnologie maakt supergevoelige live monitoring van menselijke biomoleculen mogelijk
Hoofdlijnen
- Voeding door mensen verandert het gedrag en de fysiologie van groene schildpadden op de Canarische Eilanden
- Typen biologie-experimenten
- Oude scheikunde kan verklaren waarom levende wezens ATP gebruiken als de universele energievaluta
- Hoe empathie werkt
- Kunnen tweelingen elkaar voelen?
- Een kunstmatige eiwitschil maken om COVID-19 te bestrijden
- Iran verhuist om laatste mascotte Aziatische cheeta's te redden
- Anatomie en fysiologie van een synapsenstructuur
- Sahelanthropus, de oudste vertegenwoordiger van de mensheid, was inderdaad tweevoetig
- "What Does Heterozygous Mean?

- Studie onderzoekt langere levensduur door gebrekkige RNA-verwerking
- Kunnen familieleden van wilde aardappelen de zebrachipziekte helpen temmen?

- Onderzoek met bacteriën brengt wetenschappers een stap dichter bij het maken van kunstmatige cellen met levensechte functionaliteit
- Motoreiwitten vervoeren kostbare lading in neuronen. Hoe kunnen we hun bewegingen controleren?
 Onderzoekers gebruiken DNA-origamitechniek om nanoantennes te bouwen met dockingsites
Onderzoekers gebruiken DNA-origamitechniek om nanoantennes te bouwen met dockingsites Wat zijn de oorzaken van de extreme temperatuurverschillen op de maan?
Wat zijn de oorzaken van de extreme temperatuurverschillen op de maan?  Ziek uit gezonde bloedcellen sorteren - natuurkundigen ontdekken nieuw effect
Ziek uit gezonde bloedcellen sorteren - natuurkundigen ontdekken nieuw effect Nieuwe katalysator kan betere lithium-zwavelbatterijen mogelijk maken, voeding van de volgende generatie elektronica
Nieuwe katalysator kan betere lithium-zwavelbatterijen mogelijk maken, voeding van de volgende generatie elektronica Kleurveranderende elektronische huid kan draagbare technologie en prothetische toepassingen hebben
Kleurveranderende elektronische huid kan draagbare technologie en prothetische toepassingen hebben Diamanten schitteren in energieopslagoplossing
Diamanten schitteren in energieopslagoplossing Introductie van een nieuwe isotoop:Mendelevium-244
Introductie van een nieuwe isotoop:Mendelevium-244 Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

