Wetenschap
Netwerkopbouw door celdeling:hoe zenuwcellen in de hersenen verbinding maken tijdens de ontwikkeling
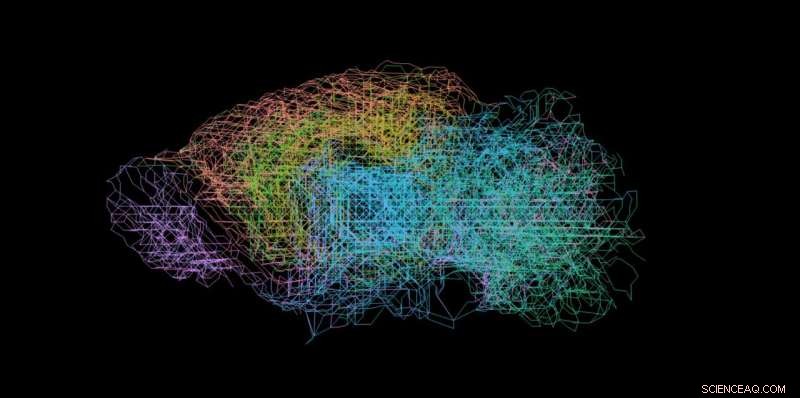
Het model produceert een realistisch netwerk van neuronen. Krediet:ETH Zürich / Stan Kerstjens
Onderzoekers van ETH Zürich hebben een model ontwikkeld dat verklaart hoe zenuwcellen in de hersenen tijdens de ontwikkeling met elkaar in verbinding staan. Hun model laat zien dat de cruciale factor progressieve celdeling is. Dit proces leidt op natuurlijke wijze tot de vorming van moleculaire adressen waarmee neuronen kunnen navigeren.
Het menselijk brein is verreweg het meest complexe orgaan dat de natuur ooit heeft voortgebracht:100 miljard zenuwcellen, elk verbonden met andere cellen via verschillende contactpunten, zorgen ervoor dat onze vaardigheden het vermogen tot opmerkelijke denkkracht bevatten. Maar hoe dit uitzonderlijke orgaan erin slaagt zich te vormen vanuit wat begint als een ongestructureerde cluster van embryonale cellen, blijft onduidelijk.
Geen definitieve blauwdruk
De afgelopen jaren zijn enorme bedragen aan onderzoeksgeld gestoken in het nauwkeurig onderzoeken van de structuur van de volledig gevormde hersenen. De wetenschappelijke gemeenschap hoopt dat het volledig in kaart brengen van neuronen en hun verbindingen - gezamenlijk bekend als het connectoom - een beter begrip zal opleveren van hoe de hersenen werken.
De complementaire fundamentele vraag hoe de hersenen zich vormen uit beperkte genetische informatie blijft echter onbeantwoord. Om het connectoom te beschrijven, zouden genen een miljard keer meer informatie moeten bevatten dan ze in werkelijkheid doen. Dus hoe komt het dat mensen en dieren worden geboren met een complex, grotendeels voorgestructureerd brein dat hen in staat stelt snel vooruitgang te boeken, bijna zodra ze geboren zijn?
Instructies voor het verbinden
Het antwoord op deze puzzel is verrassend eenvoudig, zegt Stan Kerstjens, een doctoraalstudent aan het Instituut voor Neuro-informatica van ETH Zürich en de Universiteit van Zürich, en zijn twee adviseurs Richard Hahnloser, hoogleraar systeemneurowetenschappen, en Rodney Douglas, emeritus hoogleraar neuro-informatica .
"Het is duidelijk dat de instructies voor het bedraden van de hersenen genetisch gecodeerd moeten zijn - anders zouden de hersenen van mensen niet allemaal een vergelijkbare structuur ontwikkelen", zegt Kerstjens. "Het is echter niet het gedetailleerde connectoom dat wordt gecodeerd, maar eerder een enkele compacte zoekmethode. Deze methode kan vervolgens worden gebruikt door de axonen, de lange vezels die contact maken met andere cellen. Het netwerk wordt vervolgens gebouwd door axonen die zoeken naar cellen die genetische verwanten zijn van hun eigen neuron."
Ruimtelijke en genetische structuur
Dit nieuwe mechanisme wordt beschreven in een artikel dat onlangs is gepubliceerd in het tijdschrift PLOS Computational Biology . De onderzoekers hebben een model ontwikkeld waarmee ze de ontwikkeling van de hersenen van een muis in embryonale en volwassen stadia kunnen simuleren. In menselijke termen komt dit overeen met het stadium van volwassenheid van een zesjarig kind.
"Het is in wezen een groeimodel voor weefsel", legt Kerstjens uit. Het model begint met een enkele cel. Naarmate nieuwe neuronen ontstaan, leidt elke celdeling tot gestructureerde veranderingen in genexpressie. Dit mechanisme zorgt ervoor dat elke dochtercel een vergelijkbare, maar niet identieke, genexpressie heeft als zijn ouder, en dat cellen met vergelijkbare genexpressie bij elkaar worden gegroepeerd. De door de ontwikkeling opgelegde organisatie van de cellen zorgt ervoor dat ze worden gemarkeerd als punten op een kaart, die de biologie van de hersenen kan gebruiken voor axonnavigatie.
Systematische opeenvolging van cellen
Tijdens de embryonale ontwikkeling brengt dit proces een hiërarchie van genetische markers tot stand in verschillende hersengebieden, die elk worden gekenmerkt door het genetische patroon van hun gedeelde voorouders. Navigeren door de ruimte die wordt beschreven door deze kaartachtige hiërarchie omvat het volgen van een systematische reeks genetische profielen die zich bij elke nieuwe generatie cellen hebben ontwikkeld.
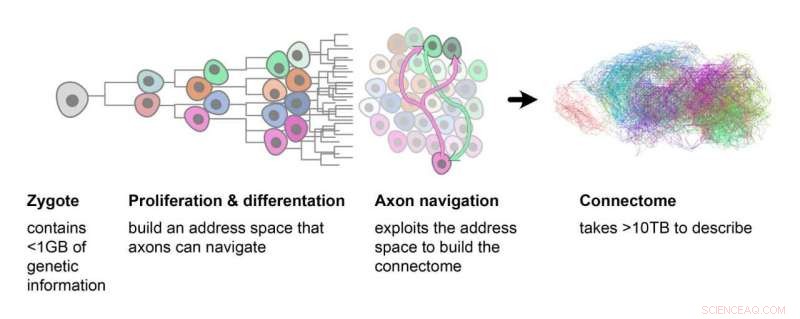
Het proces van het maken van het connectoom begint met de eicel. Dit verdeelt zich in zones, die elk cellen bevatten met een ander genetisch profiel. De axonen gebruiken deze informatie om hun weg naar hun doelbestemming te vinden. Krediet:ETH Zürich / Stan Kerstjens
Hier analyseerden de onderzoekers genexpressiegegevens over de hersenen van muizen die werden gepubliceerd door het Allen Institute for Brain Science in Seattle. "We vergeleken de laboratoriumgegevens met onze simulaties en zagen dat ze grotendeels overeenkwamen. We zien dus dat de expressie van de genen de hersenen in feite verdeelt in verschillende, maar verwante regio's", legt Kerstjens uit.
Zoeken naar gerelateerde cellen
In de tweede fase van het model verbinden de cellen zich met andere cellen. "Hier geven we ze alleen basisinstructies over welke moleculaire signalen de axonen moeten gebruiken om ze op weg te helpen", vervolgt Kerstjens. "In wezen vertelden we iedereen om de genetische patronen te traceren die zijn eigen individuele ontwikkeling bepaalden. Het was vervolgens aan de axonen zelf om de moleculaire richtingen naar de adressen van hun relaties te volgen."
De onderzoekers hebben kunnen aantonen dat dit relatief eenvoudige mechanisme axonen over grote afstanden naar bepaalde cellen kan leiden, waardoor een connectoom ontstaat dat sterk lijkt op dat van een echt muizenbrein. "De meeste cellen maken verbinding met anderen die zich dichtbij bevinden, terwijl een paar helemaal naar zeer verre regio's gaan. Dit geeft aanleiding tot verschillende delen van de hersenen, elk met hechte netwerken terwijl ze ook verbonden zijn met andere gebieden ", zeggen de onderzoekers.
Toch verklaart dit eenvoudige model het in kaart brengen van een echt menselijk brein niet volledig. "Maar dat was niet het doel van ons werk", zegt Kerstjens. "We willen het principe begrijpen van hoe een orgaan dat kan leren wordt gemaakt. En het werk dat we tot nu toe hebben gedaan, laat ons zien welke richting toekomstig onderzoek kan uitgaan." + Verder verkennen
Verre delen van het menselijk brein zijn met elkaar verbonden door verrassend weinig verbindingen
 Onderzoekers ontwikkelen eenvoudige methode om melkproducten in 3D te printen
Onderzoekers ontwikkelen eenvoudige methode om melkproducten in 3D te printen Platina-grafeen brandstofcelkatalysatoren vertonen superieure stabiliteit ten opzichte van platina in bulk
Platina-grafeen brandstofcelkatalysatoren vertonen superieure stabiliteit ten opzichte van platina in bulk Computermodel kan wetenschappers helpen uit elkaar te gaan, eiwitten opnieuw samenstellen op commando
Computermodel kan wetenschappers helpen uit elkaar te gaan, eiwitten opnieuw samenstellen op commando Door licht geïnduceerde modificatie van een carbonzuur met een aminocyclopropenon
Door licht geïnduceerde modificatie van een carbonzuur met een aminocyclopropenon Extreme verbetering van koolwaterstofvergassing via mechanochemie
Extreme verbetering van koolwaterstofvergassing via mechanochemie
Hoofdlijnen
- Archeologie en ecologie geven samen een vollediger beeld van vroegere relaties tussen mens en natuur
- Vijf soorten isolatie in de biologie
- IJsberen verdringen op Russisch eiland in teken van Arctische verandering
- Onderzoek naar de rol van α-ketoglutaarzuur (AKG) en zijn receptor OXGR1 bij de rijping van mannelijk sperma
- De snelheid van verval berekenen
- Verschillen tussen lichaamscellen en neuronen
- Wat zijn 3 functies van de navelstreng?
- Nieuwe mobiele app diagnosticeert gewasziekten in het veld en waarschuwt boeren op het platteland
- Relatie tussen ademhaling en stofwisseling
 PV, wind, batterijen:onderzoek naar energievooruitzichten
PV, wind, batterijen:onderzoek naar energievooruitzichten Japans ANA zegt nog 20 Boeing 787 Dreamliners te kopen
Japans ANA zegt nog 20 Boeing 787 Dreamliners te kopen Nieuw rapport biedt blauwdruk voor regulering van gezichtsherkenningstechnologie
Nieuw rapport biedt blauwdruk voor regulering van gezichtsherkenningstechnologie Geconstrueerde structuren die de lichtsnelheid kunnen veranderen, kunnen voordelen opleveren voor optische communicatiesystemen
Geconstrueerde structuren die de lichtsnelheid kunnen veranderen, kunnen voordelen opleveren voor optische communicatiesystemen Computersimulatie van receptoren onthult een nieuwe ligandbindingsplaats
Computersimulatie van receptoren onthult een nieuwe ligandbindingsplaats Uitvoer- en uitvoertabellen uitleggen in Algebra
Uitvoer- en uitvoertabellen uitleggen in Algebra Het vermogen van inktvissen om de kleur en helderheid van hun irisatie af te stemmen, komt neer op een subtiel mechanisme
Het vermogen van inktvissen om de kleur en helderheid van hun irisatie af te stemmen, komt neer op een subtiel mechanisme Experiment maakt snapshots van licht, stopt licht, gebruikt licht om eigenschappen van materie te veranderen
Experiment maakt snapshots van licht, stopt licht, gebruikt licht om eigenschappen van materie te veranderen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com