
Wetenschap
Een doorbraak op het gebied van cellulaire engineering:high-yield CRISPR zonder virale vectoren

Een team van wetenschappers van Gladstone en UC San Francisco ontwikkelde een nieuwe aanpak met behulp van CRISPR om enorme hoeveelheden cellen te produceren voor therapeutische toepassingen. Krediet:Michael Short/Gladstone Institutes
Een nieuwe variant van het CRISPR-Cas9-genbewerkingssysteem maakt het gemakkelijker om enorme hoeveelheden cellen opnieuw te ontwerpen voor therapeutische toepassingen. De aanpak, ontwikkeld door Gladstone Institutes en UC San Francisco (UCSF), stelt wetenschappers in staat om bijzonder lange DNA-sequenties te introduceren op precieze locaties in het genoom van cellen met opmerkelijk hoge efficiëntie zonder de virale afgiftesystemen die traditioneel werden gebruikt om DNA in cellen te transporteren.
"Een van onze doelen voor vele jaren was om lange DNA-instructies in een gerichte site in het genoom te plaatsen op een manier die niet afhankelijk is van virale vectoren", zegt Alex Marson, MD, Ph.D., directeur van de Gladstone -UCSF Institute of Genomic Immunology en senior auteur van de nieuwe studie. "Dit is een enorme stap in de richting van de volgende generatie veilige en effectieve celtherapieën."
In het nieuwe artikel gepubliceerd in het tijdschrift Nature Biotechnology , Marson en zijn collega's beschrijven niet alleen de technologie, maar laten ook zien hoe deze kan worden gebruikt om CAR-T-cellen te genereren met het potentieel om multipel myeloom, een bloedkanker, te bestrijden, en om gensequenties te herschrijven waarbij mutaties kunnen leiden tot zeldzame erfelijke ziekten.
"We hebben aangetoond dat we meer dan een miljard cellen in een enkele run kunnen ontwikkelen, wat ver boven het aantal cellen ligt dat we nodig hebben om een individuele patiënt te behandelen", zegt eerste auteur Brian Shy, MD, Ph.D., een klinische fellow in het lab van Marson.
Van dubbel- naar enkelstrengs DNA
CRISPR-Cas9, een systeem dat genen in levende cellen bewerkt, is het afgelopen decennium gebruikt als een fundamenteel onderzoeksinstrument. Steeds meer klinische wetenschappers zijn enthousiast over het potentieel van CRISPR-Cas9 om levende celtherapieën te genereren.
Met genbewerking kan men onder andere een gemuteerd, ziekteverwekkend gen uitschakelen, verwijderen of vervangen, of de kankerbestrijdende activiteit van een immuuncel stimuleren. Hoewel de eerste therapeutische toepassingen van CRISPR-Cas9 onlangs in klinische proeven zijn opgenomen, is de technologie nog steeds beperkt door de uitdaging om veilig grote hoeveelheden correct bewerkte cellen te maken.
Traditioneel vertrouwden onderzoekers op virale vectoren - de omhulsels van virussen zonder hun ziekteverwekkende componenten - om het DNA (de DNA-sjabloon genoemd) dat voor gentherapie wordt gebruikt, in cellen te dragen. Het produceren van grote hoeveelheden virale vectoren van klinische kwaliteit is echter een belangrijk knelpunt geweest bij het verkrijgen van celtherapieën bij patiënten. Bovendien kunnen onderzoekers niet gemakkelijk controleren waar traditionele virale vectoren genen in het genoom invoegen.
"Het gebruik van virale vectoren is duur en arbeidsintensief", zegt Shy. "Een groot voordeel van een niet-virale benadering van gen-engineering is dat we niet zo beperkt zijn door kosten, productiecomplexiteit en uitdagingen in de toeleveringsketen."
In 2015 toonde de groep van Marson - in samenwerking met het laboratorium van CRISPR-pionier Jennifer Doudna, Ph.D. - voor het eerst aan dat ze korte DNA-sjablonen in immuuncellen konden invoegen zonder virale vectoren, met behulp van een elektrisch veld dat de buitenmembranen van cellen meer doorlaatbaar maakt . In 2018 ontwikkelden ze een methode om langere DNA-sequenties in immuuncellen te knippen en te plakken met CRISPR en publiceerden deze in Nature .
Vervolgens ontdekten de onderzoekers in 2019 dat ze door ook een aangepaste versie van de DNA-sjablonen te gebruiken die kunnen binden aan het Cas9-enzym - hetzelfde eiwit dat als moleculaire schaar fungeert tijdens CRISPR-genbewerking - de nieuwe sequenties aan het beoogde genoom konden leveren website efficiënter. Dat werk is gepubliceerd in Nature Biotechnology .
Er was echter meer werk nodig om de opbrengst van succesvol gemanipuleerde immuuncellen te verbeteren en het proces compatibel te maken met de productie van toekomstige celtherapieën. Die doelen motiveerden de huidige studie van het team.
DNA kan bestaan in enkele of dubbele strengen (zoals tegenover elkaar liggende stukken klittenband), en Cas9 hecht zich aan dubbelstrengs DNA. De onderzoekers ontdekten al snel dat hoge niveaus van dubbelstrengs DNA-template giftig kunnen zijn voor cellen, dus de methode kan alleen worden gebruikt met kleine hoeveelheden template-DNA, wat leidt tot een lage efficiëntie.
Het team wist dat enkelstrengs DNA minder toxisch was voor cellen, zelfs bij relatief hoge concentraties. In het nieuwe artikel beschrijven ze dus een methode om het gemodificeerde Cas9-enzym aan een enkelstrengs sjabloon-DNA te hechten, door slechts een kleine overhang van dubbelstrengs DNA aan de uiteinden toe te voegen.
"Dit geeft ons een evenwichtige, best-of-both-worlds-benadering", zegt Marson.
Enkelstrengs sjabloon-DNA zou de efficiëntie van genbewerking meer dan kunnen verdubbelen in vergelijking met de oudere, dubbelstrengs benadering. En dankzij de dubbelstrengs uiteinden van de moleculen kunnen onderzoekers Cas9 gebruiken om de afgifte van niet-virale vectoren in cellen te verbeteren.
"Deze technologie heeft het potentieel om nieuwe cel- en gentherapieën sneller, beter en goedkoper te maken", zegt Jonathan Esensten, MD, Ph.D., een auteur van het nieuwe werk, een assistent-professor laboratoriumgeneeskunde aan de UCSF en een aangesloten onderzoeker bij Gladstone.
Een pad naar de kliniek
In de studie gebruikten onderzoekers de nieuwe DNA-sjabloon om meer dan een miljard CAR-T-cellen te genereren die gericht zijn op multipel myeloom. CAR-T-cellen zijn immuun-T-cellen die genetisch zijn gemodificeerd om specifieke cellen of kankers effectief te bestrijden. Met de nieuwe enkelstrengs, Cas9-gestuurde sjablonen kreeg ongeveer de helft van alle T-cellen het nieuwe gen en als resultaat werden ze omgezet in CAR-T-cellen.
"We wisten dat het richten van de DNA-templates op een specifieke locatie in het genoom, de TRAC-site genaamd, de antitumorkracht van CAR-T-cellen zou verbeteren", zegt Justin Eyquem, Ph.D., een co-auteur van de nieuw artikel, assistent-professor geneeskunde in de afdeling Hematologie en Oncologie bij UCSF, en aangesloten onderzoeker bij Gladstone. "Deze nieuwe niet-virale benadering stelt ons in staat om die targeting veel efficiënter te bereiken, wat de ontwikkeling van de volgende generatie CAR-T-celtherapieën zal versnellen."
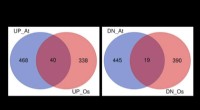
Bovendien toonden de onderzoekers aan dat hun aanpak voor het eerst in hun geheel twee genen kon vervangen die geassocieerd zijn met zeldzame genetische immuunziekten, de IL2RA- en de CTLA4-genen.
In het verleden hadden wetenschappers aangetoond dat ze kleine delen van het IL2RA-gen konden vervangen waar bepaalde patiënten mutaties hebben. Nu heeft het team van Marson bewezen dat ze de hele IL2RA- en CTLA4-genen in één keer kunnen vervangen - een "one size fits all"-benadering die veel patiënten met verschillende mutaties in deze genen zou kunnen behandelen, in plaats van gepersonaliseerde sjablonen te moeten genereren voor de mutatie van elke patiënt. Bijna 90 procent van de cellen die met deze benadering van genmanipulatie werden behandeld, kreeg de gezonde versies van de genen.
De onderzoekers zijn nu op zoek naar goedkeuring om klinische proeven te bevorderen met behulp van niet-virale CRISPR-technologie in zowel CAR-T-celtherapie als de behandeling van IL2RA-deficiëntie. + Verder verkennen
Studie moedigt voorzichtige benadering van CRISPR-therapieën aan
 Noch glad noch ruw:nieuwe bio-geïnspireerde oppervlakken laten insecten wegglijden
Noch glad noch ruw:nieuwe bio-geïnspireerde oppervlakken laten insecten wegglijden Autonome zelfgenezing gezien in piëzo-elektrische moleculaire kristallen
Autonome zelfgenezing gezien in piëzo-elektrische moleculaire kristallen Nieuwe materialen om branden in lithium-ionbatterijen te helpen stoppen, explosies en de prestaties van de batterij verbeteren
Nieuwe materialen om branden in lithium-ionbatterijen te helpen stoppen, explosies en de prestaties van de batterij verbeteren Een nieuwe manier om opeenvolgingen van chemische reacties te automatiseren
Een nieuwe manier om opeenvolgingen van chemische reacties te automatiseren Hoe een fractionele destillatiekolom te bouwen
Hoe een fractionele destillatiekolom te bouwen
 Nieuwe oceaanobservaties verbeteren het begrip van beweging
Nieuwe oceaanobservaties verbeteren het begrip van beweging Als de wind vermurwen, verschroeide Californië hoopt op hulp bij brand
Als de wind vermurwen, verschroeide Californië hoopt op hulp bij brand Het verschil tussen meerval en tilapia
Het verschil tussen meerval en tilapia  EU-hof zegt dat Polen luchtkwaliteitswetten heeft overtreden
EU-hof zegt dat Polen luchtkwaliteitswetten heeft overtreden GPM Satellite ziet Jebi als een nieuwe tropische bedreiging voor Japan
GPM Satellite ziet Jebi als een nieuwe tropische bedreiging voor Japan
Hoofdlijnen
- Kan lachen ziekten genezen?
- Update over bedreigde Filippijnse cycadsoorten
- Hoe wordt ureum gemaakt?
- Wat is een markermolecuul?
- Onderzoekers krijgen voor het eerst een volledig beeld van eiwit achter tastzin
- Belangrijke soorten bacteriën
- Gespecialiseerde cellen in het lichaam
- Honden kunnen ruiken als ze gestrest zijn, suggereert onderzoek
- EU stelt stemming over verlenging omstreden vergunning voor onkruidverdelger uit
- Vissenseks zo luid dat dolfijnen doof kunnen worden

- Een onwaarschijnlijke held vergiftigen bij het afweren van exotische indringers?

- Masterchef-techniek blijkt levensreddend te zijn voor bedreigde zeeschildpadeieren

- Nieuw geïdentificeerde genen kunnen gewassen helpen beschermen tegen overstromingen
- Kaperparasiet geblokkeerd voor infiltratie van bloed
 Zenuwachtige optische veter geeft robots een menselijke touch
Zenuwachtige optische veter geeft robots een menselijke touch Ingenieur creëert nieuwe techniek om nanomaterialen te testen
Ingenieur creëert nieuwe techniek om nanomaterialen te testen Mars is bezaaid met 15.694 kilo menselijk afval van 50 jaar robotverkenning
Mars is bezaaid met 15.694 kilo menselijk afval van 50 jaar robotverkenning Hoe het focussen op emoties helpt om politieke spanningen te verminderen
Hoe het focussen op emoties helpt om politieke spanningen te verminderen Nieuw klimaatmodel helpt onderzoekers waterbehoefte beter te voorspellen
Nieuw klimaatmodel helpt onderzoekers waterbehoefte beter te voorspellen Wat is inertie?
Wat is inertie?  MRI-compatibele metalen
MRI-compatibele metalen  Waarom gifkikkers zichzelf niet vergiftigen?
Waarom gifkikkers zichzelf niet vergiftigen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

