
Wetenschap
Onderzoekers construeren het meest complexe, volledig synthetische microbioom
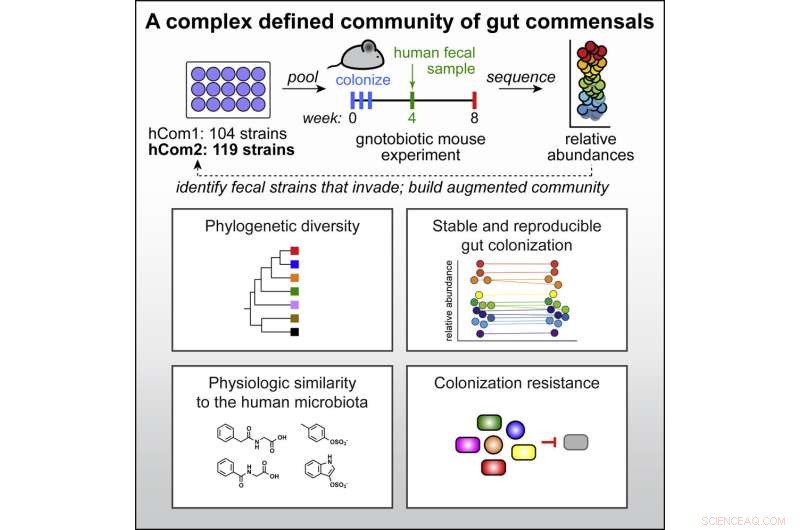
Grafisch abstract. Tegoed:Cel (2022). DOI:10.1016/j.cell.2022.08.003
Belangrijke studies in het afgelopen decennium hebben aangetoond dat het darmmicrobioom, de verzameling van honderden bacteriesoorten die in het menselijke spijsverteringsstelsel leven, de neurale ontwikkeling, de respons op kankerimmunotherapieën en andere aspecten van de gezondheid beïnvloedt. Maar deze gemeenschappen zijn complex en zonder systematische manieren om de bestanddelen te bestuderen, blijven de exacte cellen en moleculen die verband houden met bepaalde ziekten een mysterie.
Onderzoekers van Stanford University hebben het meest complexe en goed gedefinieerde synthetische microbioom gebouwd, waardoor een gemeenschap van meer dan 100 bacteriesoorten is ontstaan die met succes in muizen zijn getransplanteerd. De mogelijkheid om individuele soorten toe te voegen, te verwijderen en te bewerken, stelt wetenschappers in staat de verbanden tussen het microbioom en gezondheid beter te begrijpen en uiteindelijk eersteklas microbioomtherapieën te ontwikkelen.
Er zijn veel belangrijke microbioomstudies gedaan met behulp van fecale transplantaties, die het volledige, natuurlijke microbioom van het ene organisme naar het andere introduceren. Terwijl wetenschappers routinematig een gen tot zwijgen brengen of een eiwit uit een specifieke cel of zelfs een hele muis verwijderen, is er niet zo'n set hulpmiddelen om één soort van de honderden in een bepaald fecaal monster te verwijderen of aan te passen.
"Zoveel van wat we weten over biologie, zouden we niet weten zonder het vermogen om complexe biologische systemen stuk voor stuk te manipuleren", zegt Michael Fischbach, Institute Scholar bij Sarafan ChEM-H en corresponderende auteur van de studie, gepubliceerd in cel op 6 september.
Fischbach, universitair hoofddocent bio-engineering en microbiologie en immunologie, en anderen zagen één oplossing:bouw een microbioom van de grond af door individueel te groeien en vervolgens de samenstellende bacteriën te mengen.
De ark bouwen
Elke cel in het microbioom bezet een specifieke functionele niche en voert reacties uit die moleculen afbreken en opbouwen. Om een microbioom te bouwen, moest het team ervoor zorgen dat het uiteindelijke mengsel niet alleen stabiel was en een evenwicht handhaafde zonder dat een enkele soort de rest overweldigde, maar ook functioneel was, waarbij alle acties van een compleet, natuurlijk microbioom werden uitgevoerd. Het selecteren van soorten om in hun synthetische gemeenschap op te nemen was ook moeilijk gezien de natuurlijke variatie tussen individuen; twee willekeurig geselecteerde mensen delen minder dan de helft van hun microbiële genen.
De onderzoekers besloten hun kolonie op te bouwen met de meest voorkomende bacteriën en wendden zich tot het Human Microbiome Project (HMP), een initiatief van de National Institutes of Health om de volledige microbiële genomen van meer dan 300 volwassenen te sequensen.
"We waren op zoek naar de ark van Noach van bacteriesoorten in de darm van de mens en probeerden die te vinden die er bijna altijd waren in elk individu", zei Fischbach.
Ze selecteerden meer dan 100 bacteriestammen die aanwezig waren in ten minste 20% van de HMP-individuen. Door een paar soorten toe te voegen die nodig waren voor een aantal latere studies, kwamen ze op 104 soorten, die ze in individuele stammen kweekten en vervolgens vermengden tot één gecombineerde cultuur om te maken wat ze menselijke gemeenschap één noemen, of hCom1.
Hoewel ze ervan overtuigd waren dat de stammen naast elkaar konden bestaan in het laboratorium, was de echte test of hun nieuwe kolonie wortel zou schieten in de darm. Ze introduceerden hCom1 bij muizen die zorgvuldig zijn ontworpen om geen bacteriën te bevatten. hCom1 was opmerkelijk stabiel, met 98% van de samenstellende soorten die de darm van deze kiemvrije muizen koloniseerden, en de relatieve abundantieniveaus van elke soort bleven gedurende twee maanden constant.
Buitenlandse invasie
Om hun kolonie completer te maken, wilden de onderzoekers ervoor zorgen dat alle vitale microbioomfuncties door een of meer soorten zouden worden uitgevoerd. They relied on a theory called colonization resistance, which explains that any bacterium, when introduced into an existing colony, will only survive if it can fill a niche not already occupied.
By introducing a complete microbiome, in the form of a human fecal sample, to their colony and tracking any new species that took up residence, they could build a more complete community.
Some were skeptical that this would work. "The bacterial species in hCom1 had lived together for only a few weeks," said Fischbach. "Here we were, introducing a community that had coexisted for a decade. Some people thought they would decimate our colony."
Remarkably, hCom1 held its own, and only about 10% of cells in the final community came from the fecal transplant.
They found over 20 new bacterial species that inserted themselves in at least two of their three fecal transplant studies. Adding those to their initial community and removing those that failed to take root in mouse guts gave them a new community of 119 strains, dubbed hCom2. This second iteration, still made from individually growing and then mixing the constituents, made mice even more resistant to fecal challenges than the first.
Final challenge
To demonstrate the utility of their synthetic microbiome, the team took hCom2-colonized mice and challenged them with a sample of E. coli. These mice, like those that were colonized with a natural microbiome, resisted infection.
Prior studies have shown that a healthy natural microbiome leads to protection, but Fischbach and colleagues could take this a step further by iteratively eliminating or modifying certain strains to determine which ones specifically conferred protection. They found several key bacteria and plan to conduct further studies to narrow down to the most critical species.
Fischbach believes that hCom2, or future versions of it, will enable similar reductionist studies that reveal the bacterial agents involved in other areas, like immunotherapy responses.
"We built this consortium for the broader research community. We want to get this into as many hands as possible to have an impact on the field," said Fischbach.
He also envisions that this method of building a microbiome from the ground up will make engineered microbiome-based therapies possible in the future. As the director of the Stanford Microbiome Therapies Initiative (MITI), an initiative launched in 2019 by Sarafan ChEM-H and the Department of Bioengineering, he aims to construct engineered communities that could one day be transplanted into people to treat or prevent a variety of diseases. + Verder verkennen
Ecological principles at play in gut microbiome
 Hoe GC-responsfactoren te berekenen
Hoe GC-responsfactoren te berekenen  Computermodel onthult effect van verhoogd cholesterol op specifiek ionkanaal in hart
Computermodel onthult effect van verhoogd cholesterol op specifiek ionkanaal in hart Vroege ziektediagnose kan drastisch worden verbeterd met nieuw detectiesysteem
Vroege ziektediagnose kan drastisch worden verbeterd met nieuw detectiesysteem Een verhaal over herders en helices
Een verhaal over herders en helices Natuurlijke vezels die in satellieten worden geregen voor veiligere missies
Natuurlijke vezels die in satellieten worden geregen voor veiligere missies
 Nieuwe dieptekaart van de Noordelijke IJszee
Nieuwe dieptekaart van de Noordelijke IJszee Er is maar één manier om bosbranden minder krachtig te maken:verwijder het spul dat brandt
Er is maar één manier om bosbranden minder krachtig te maken:verwijder het spul dat brandt Een manier om groene infrastructuur in uw stad te promoten
Een manier om groene infrastructuur in uw stad te promoten NASA-NOAA-satelliet vindt een zwakkere, overgang van tropische storm Halong
NASA-NOAA-satelliet vindt een zwakkere, overgang van tropische storm Halong Amerika's damcrisis - was Oroville slechts een druppel op een gloeiende plaat?
Amerika's damcrisis - was Oroville slechts een druppel op een gloeiende plaat?
Hoofdlijnen
- De vreemde empathie van plaatsvervangende schaamte
- Een model waarmee planten hun fotosynthetische stofwisseling aanpassen aan de lichtintensiteit
- Celademhalingsexperimenten
- Zoekers in Mexico vinden, maar laat los, vaquita bruinvis kalf
- Hoe vogelgriep werkt
- Dierenartsen verplegen zieke bobcat, breng het terug naar het park waar het nodig is
- Slagen, grote oceaanreservaten moeten zowel het zeeleven als de mensen ten goede komen
- milities, stropers richten grote schade aan in het wild in Centraal-Afrika:monitor
- Nieuwe screeningstechniek stelt veredelaars in staat sneller droogteresistente rassen te ontwikkelen
- Meisjes zullen jongens zijn:geslachtsverandering bij drakenhagedissen

- Laatste gemeenschappelijke aap-menselijke voorouder was waarschijnlijk zo groot als een gibbon

- Wetenschappers maken cellen die de tastzin mogelijk maken
- Bacteriën met synthetisch gencircuit zelf-assembleren om werkend apparaat te bouwen met gouden nanodeeltjes
- AI-graanbeoordeling zaait zaden voor een beter rendement

 Spin-opruimingsmethode brengt praktische kwantumcomputers dichter bij de realiteit
Spin-opruimingsmethode brengt praktische kwantumcomputers dichter bij de realiteit Onderzoekers ontdekken nieuwe manier om de immuunrespons van het lichaam te stimuleren
Onderzoekers ontdekken nieuwe manier om de immuunrespons van het lichaam te stimuleren Verband tussen continentaal uiteenvallen, vulkanische koolstofemissies en evolutie
Verband tussen continentaal uiteenvallen, vulkanische koolstofemissies en evolutie Hoe werkt IR-spectroscopie?
Hoe werkt IR-spectroscopie?  Astronomen zien een knipperende reus nabij het centrum van de melkweg
Astronomen zien een knipperende reus nabij het centrum van de melkweg Afvang en gebruik van kooldioxide kan big business worden
Afvang en gebruik van kooldioxide kan big business worden Wat is er gebeurd met de Apollo goodwill maanstenen?
Wat is er gebeurd met de Apollo goodwill maanstenen? De geo-engineering van toestemming:hoe samenzweerders de klimaatwetenschappelijke inhoud van YouTube domineren
De geo-engineering van toestemming:hoe samenzweerders de klimaatwetenschappelijke inhoud van YouTube domineren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

