
Wetenschap
Onderzoekers ontrafelen de kristalstructuur van een belangrijk enzym van SARS-CoV-2, wat de weg vrijmaakt voor nieuwe antivirale middelen
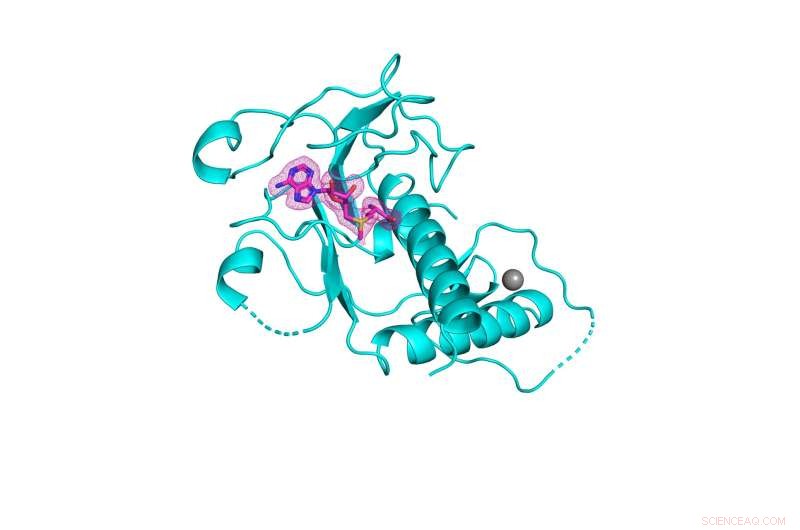
3D-structuur van SARS-CoV-2 nsp14-methyltransferasedomein (weergegeven in cyaan) gebonden aan zijn natuurlijke cofactor S-adenosylmethionine (weergegeven in roze gaas). Krediet:Kottur, et al; Natuur Structurele en moleculaire biologie
Een team van onderzoekers van de berg Sinaï heeft een kristalstructuur met hoge resolutie geproduceerd van een enzym dat essentieel is voor het overleven van SARS-CoV-2, het virus dat COVID-19 veroorzaakt. De ontdekking zou kunnen leiden tot het ontwerp van broodnodige nieuwe antivirale middelen om huidige en toekomstige coronavirussen te bestrijden.
Het enzym, bekend als nsp14, heeft een cruciaal belangrijk gebied dat bekend staat als het RNA-methyltransferase-domein, dat eerdere pogingen van de wetenschappelijke gemeenschap om zijn driedimensionale kristalstructuur te karakteriseren is ontgaan. In de online editie van Nature Structural &Molecular Biology van 8 september is een paper gepubliceerd waarin het innovatieve proces wordt beschreven. .
"Door de vorm van het methyltransferasedomein van nsp14 met hoge resolutie te visualiseren, krijgen we inzicht in hoe we kleine moleculen kunnen ontwerpen die in de actieve plaats passen en zo de essentiële chemie ervan remmen", zegt senior auteur Aneel Aggarwal, Ph.D. , hoogleraar farmacologische wetenschappen aan de Icahn School of Medicine op de berg Sinaï. "Met deze structurele informatie, en in samenwerking met medicinale chemici en virologen, kunnen we nu remmers van kleine moleculen ontwerpen om toe te voegen aan de familie van antivirale middelen die hand in hand gaan met vaccins om SARS-CoV-2 te bestrijden."
Antivirale middelen op recept die zich richten op de belangrijkste enzymen van SARS-CoV-2, zijn onder meer nirmatrelvir voor de belangrijkste protease (M Pro ) enzym, en molnupiravir en remdesivir voor het RNA-polymerase (nsp12)-enzym. Onderzoek naar de ontwikkeling van nieuwe antivirale middelen die gericht zijn op verschillende enzymatische activiteiten, is in laboratoria over de hele wereld aan het versnellen, en de ontdekking van de berg Sinaï heeft daar aanzienlijk aan bijgedragen.
"Een deel van wat ons werk drijft", zegt Dr. Aggarwal, "is de kennis die is opgedaan bij de behandeling van HIV - dat je meestal een cocktail van remmers nodig hebt voor een maximale impact tegen het virus."
Het Mount Sinai-team ontwikkelde eigenlijk drie kristalstructuren van nsp14, elk met verschillende cofactoren, waaruit ze de beste basis identificeerden voor het ontwerp van antivirale middelen voor het remmen van de RNA-methyltransferase-activiteit die het enzym mogelijk maakt en het virus nodig heeft om te overleven. Volgens hun schema zou het antivirale middel de plaats innemen van de natuurlijke cofactor S-adenosylmethionine, waardoor de methyltransferasechemie zou worden voorkomen. De kristalstructuren die het team heeft opgehelderd, zijn beschikbaar gemaakt voor het publiek en zullen nu dienen als gids voor biochemici en virologen over de hele wereld om deze verbindingen te ontwikkelen.
De ontdekking mogelijk maken was het vermogen van onderzoekers om een horde te nemen die anderen in het verleden verhinderde om driedimensionale kristallen van het nsp14-methyltransferasedomein te creëren. "We gebruikten een benadering die bekend staat als fusie-geassisteerde kristallisatie", legt hoofdauteur Jithesh Kottur, Ph.D., een postdoctoraal fellow bij Icahn Mount Sinai, en een kristallograaf en biochemicus uit. "Het houdt in dat het enzym wordt gefuseerd met een ander klein eiwit dat het helpt kristalliseren."
Dr. Aggarwal, een internationaal erkende structuurbioloog, onderstreept het belang van doorlopend onderzoek door onderzoekers in zijn vakgebied tegen een virus dat wereldwijd tot miljoenen doden heeft geleid. "Het virus evolueert zo snel dat het resistentie kan ontwikkelen tegen de antivirale middelen die nu beschikbaar zijn, daarom moeten we doorgaan met het ontwikkelen van nieuwe", merkt hij op. "Vanwege de hoge sequentieconservering van nsp14 over coronavirussen en hun varianten (wat betekent dat het niet veel muteert), zal onze studie helpen bij het ontwerpen van breedspectrum antivirale middelen voor zowel huidige als toekomstige uitbraken van coronavirus." + Verder verkennen
Nieuwe studie ontdekt de driedimensionale structuur van de genoomreplicatiemachine
 Onderzoek op nationale schaal toont aan dat invasieve grassen natuurbrand bevorderen
Onderzoek op nationale schaal toont aan dat invasieve grassen natuurbrand bevorderen Nieuw artikel toont voordelen van kustherstel in Louisiana voor koolstofvastlegging in de bodem
Nieuw artikel toont voordelen van kustherstel in Louisiana voor koolstofvastlegging in de bodem Droogte, conflict en migratie in Kenia
Droogte, conflict en migratie in Kenia De tsunami in Alaska die golven veroorzaakte die zo hoog waren als de Space Needle van Seattle
De tsunami in Alaska die golven veroorzaakte die zo hoog waren als de Space Needle van Seattle Organisaties met brede sociale banden helpen herstellen van natuurrampen
Organisaties met brede sociale banden helpen herstellen van natuurrampen
Hoofdlijnen
- Nucleïnezuurfuncties
- Hoe verschillen schimmelsporen van bacteriële endosporen?
- Wat is het Baader-Meinhof-fenomeen?
- Ecosysteemherstel is een integraal onderdeel van het herstel van de mensheid van COVID-19
- Hoe elektroforese te analyseren
- Efficiënte methode voor het monitoren van soorten bewijst zijn waarde voor natuurbeheer
- DNA-ontdekking kan licht werpen op zeldzame kinderziekte
- Osmose: definitie, proces, voorbeelden
- Voor deze baleinwalvissen, jagen vereist weinig meer dan watertrappelen
- Wat zijn de functies van koolhydraten in planten en dieren?

- Wetenschappers ontdekken patronen van olifantenstroperij in Oost-Afrika

- leeuwen, chimpansees, haaien krijgen extra bescherming onder VN-verdrag

- Tsjaad breidt belangrijk natuurgebied in nationaal park uit

- Biologische klok gevonden in schimmelparasiet werpt meer licht op het fenomeen zombiemieren

 Een unieke ster die in de loop van decennia is veranderd
Een unieke ster die in de loop van decennia is veranderd Nieuwe combinatie van nanodeeltjes voor atherosclerose ontwikkeld
Nieuwe combinatie van nanodeeltjes voor atherosclerose ontwikkeld NASA's Maven observeert de nachtelijke hemel op Mars die pulseert in ultraviolet licht
NASA's Maven observeert de nachtelijke hemel op Mars die pulseert in ultraviolet licht Niet melden Voel je het? gebieden kunnen worden gebruikt om kaarten met aardbevingsintensiteit te verbeteren
Niet melden Voel je het? gebieden kunnen worden gebruikt om kaarten met aardbevingsintensiteit te verbeteren Geleerde om de toepassingen van kwantumtechnologie te bespreken
Geleerde om de toepassingen van kwantumtechnologie te bespreken Analyse toont geen verandering in Amerikaanse misdaad door legalisering van medische marihuana
Analyse toont geen verandering in Amerikaanse misdaad door legalisering van medische marihuana Raman-spectroscopie klaar om de diagnose van schildklierkanker minder invasief te maken
Raman-spectroscopie klaar om de diagnose van schildklierkanker minder invasief te maken Verbetering van de hulpmiddelen van de natuur voor het verteren van plastic
Verbetering van de hulpmiddelen van de natuur voor het verteren van plastic
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

