
Wetenschap
Hoe genen hun werkruimte delen
Artistieke impressie van een gedemonteerde organisatie-eenheid van DNA, een topologisch associërend domein (TAD). In de data-analyse verschijnen deze domeinen als driehoeken die in verschillende weefsels kunnen worden geherstructureerd. Krediet:Alessa Ringel/MPIMG
Lagen van gencontrole stellen DNA in staat om flexibel nieuwe informatie toe te voegen. Genen en hun genetische schakelaars zijn georganiseerd in functionele eenheden om genen naar behoefte aan of uit te zetten. Het verstoren van deze eenheden kan leiden tot ziekte, maar een nieuwe studie maakt duidelijk dat ze robuuster en flexibeler zijn dan eerder werd gedacht. Een internationaal team van onderzoekers ontdekte dat een gen nog steeds kan functioneren, zelfs wanneer nieuwe DNA-segmenten in dezelfde genomische organisatie-eenheid worden ingebracht.
Twee meter DNA wordt in de kleine kern van elke menselijke cel gestopt. Om de cel op het juiste moment van de juiste informatie te voorzien, wordt het DNA-molecuul efficiënt verpakt en gebundeld in functionele eenheden. Genen verzamelen zich gewoonlijk met hun controlesequenties om fysiek gescheiden werkruimten te bouwen. Maar wat gebeurt er als deze eenheden verstoord raken tijdens de evolutie – of in het genoom van een individuele patiënt?
"Sommige van de genomische herschikkingen die we in de kliniek zien, veroorzaken ziekte, terwijl andere dat niet doen", zegt Stefan Mundlos van Charité-Universitätsmedizin Berlin en hoofd van de onderzoeksgroep Development &Disease bij het Max Planck Institute for Molecular Genetics (MPIMG). "We begrijpen nog steeds niet helemaal waarom dit het geval is."
In feite bevatten veel delen van het genoom regelgevende conflicten. Een nieuwe studie gepubliceerd in het tijdschrift Cell geeft de eerste hints hoe ze worden opgelost. Het team van onderzoekers van Mundlos bestudeerde een voorbeeld waarbij een nieuw gen met succes in het genoom is geïntegreerd zonder de reeds bestaande controlemechanismen van naburige genen te verstoren. Het team hoopte dat dit ook zou kunnen worden gebruikt om conclusies te trekken over vergelijkbare omstandigheden in de cellen van patiënten.
De onderzoekers onderzochten een mutatie die plaatsvond in de voorouder van alle placentale zoogdieren, een groep die mensen omvat, maar geen buideldieren zoals de opossum. De mutatie bracht het nieuwe gen Zfp42 in de werkruimte van het belangrijke ontwikkelingsgen Fat1, een gen dat betrokken is bij de groei en migratie van cellen.
"We ontdekten dat cellen met twee afzonderlijke mechanismen omgaan met de ongewenste gast, afhankelijk van de situatie waarin de genen nodig zijn", zegt Michael Robson, die het project leidde. "In bepaalde weefsels wordt het nieuwe gen epigenetisch tot zwijgen gebracht en volledig uitgeschakeld. Tijdens de vroege ontwikkeling van het embryo zijn beide genen echter actief en bouwt de cel dit deel van het genoom om tot nieuwe functionele eenheden die individuele controle mogelijk maken." P>
Een nieuwkomer in de werkplaats
Robson, zijn Ph.D. student Alessa Ringel en hun collega's onderzochten de organisatorische werkruimte van Fat1. Net als veel andere genen, wordt het geïnstrueerd om op specifieke tijden en plaatsen in te schakelen door andere DNA-sequenties die versterkers worden genoemd. Om versterkers en genen te laten communiceren, vouwt en buigt DNA vervolgens om ze samen te brengen in een beschutte werkruimte. Deze functionele werkeenheden van DNA worden topologisch geassocieerde domeinen (TAD's) genoemd.
Bij kippen of opossums bevindt alleen het Fat1-gen zich in dezelfde TAD als zijn versterkers. Toen de onderzoeker de "Hi-C"-techniek gebruikte om te zien welke delen van het DNA elkaar het vaakst raken, gedroegen het gen en zijn versterker zich zoals verwacht. Bij deze dieren leek het DNA zich op te rollen tot een enkele bal, waardoor beide genetische sequenties zich konden vermengen, waardoor Fat1 werd geactiveerd.
"Maar bij placentale zoogdieren zoals muizen of mensen is het iets gecompliceerder", legt Ringel uit, de eerste auteur van de publicatie. Precies tussen het Fat1-gen en zijn versterker in, is er dit nieuwe gen genaamd Zfp42. Dezelfde versterker zou beide genen moeten controleren, maar dit is niet het geval. "Beide genen lijken prima met elkaar overweg te kunnen - ze gedragen zich volledig onafhankelijk en worden actief in verschillende weefsels op verschillende tijdstippen van ontwikkeling."
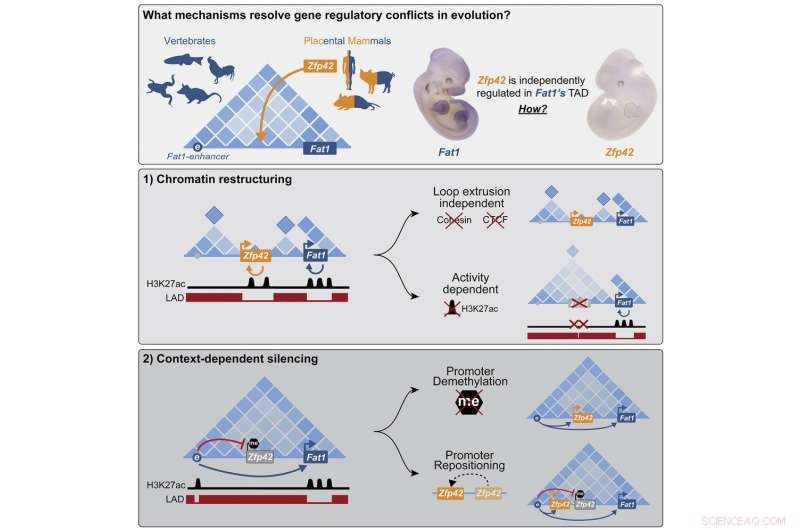
Grafisch abstract. Tegoed:Cel (2022). DOI:10.1016/j.cell.2022.09.006
Ga slapen of bouw je werkruimte opnieuw op
Om de vraag te beantwoorden hoe de genen elkaar weten te ontwijken, vergeleken de onderzoekers cellen van verschillende muisweefsels:de zich ontwikkelende embryonale ledemaat en embryonale stamcellen.
Uit deze studies leerden de onderzoekers dat in embryonale ledematen de versterker inderdaad contact maakt met beide genen, maar Zfp42 blijft inactief. Het blijkt dat de nieuwkomer nog steeds in dezelfde werkruimte zit maar rustig in een hoekje ligt te slapen. Het gen was tot zwijgen gebracht door DNA-methylatie, een chemische modificatie die genen in een off-state vergrendelt. Maar om het Zfp42-gen in slaap te brengen, moet het precies op de goede plek zitten. Zodra de onderzoekers het experimenteel een beetje naar beide kanten knipten en plakten, werd het geactiveerd door de versterker van Fat1.
De wetenschappers waren verrast toen ze ontdekten dat in de cellen van de embryonale stamcellen van muizen het DNA rond de twee genen heel anders is georganiseerd. Zfp42 en Fat1 bouwen nu hun eigen fysiek gescheiden werkruimten met hun eigen respectievelijke versterkers.
De originele TAD splitst zich in kleinere DNA-blobs om de twee genen te scheiden. Dit bleek niet alleen uit Hi-C-experimenten die de contactpunten tussen DNA-segmenten in kaart brachten, maar ook uit microscopische beeldvorming met hoge resolutie en computermodellen die aantoonden dat elk gen zijn eigen kleine werkruimte instelde.
Een robuust en flexibel systeem van genetische controle
Deze twee nieuwe mechanismen onthullen hoe een enkele DNA-"werkruimte" gemakkelijk kan worden aangepast om geheel verschillende genactiviteiten te hosten. "Het is fascinerend om te onderzoeken hoe verschillende lagen van gencontrole elkaar aanvullen", zegt Ringel. "We zijn verrast door de flexibiliteit van onze genomen om genen in verschillende situaties aan te passen en te controleren. Onze resultaten laten bijvoorbeeld zien dat TAD's dynamische in plaats van statische DNA-structuren kunnen hebben."
De TAD van het Fat1-gen is gedurende honderden miljoenen jaren van evolutie van vissen en kikkers tot buideldieren stabiel gehandhaafd, voegt projectleider Robson toe. "TAD-werkruimten lijken in eerste instantie kwetsbaar, omdat er zoveel mis kan gaan als ze gestoord worden", zegt hij. "Maar nieuwe genen moeten ergens heen en we laten zien hoe evolutie regulerende domeinen effectief kan wijzigen om veilig nieuwe genen en functies toe te voegen."
"Interessant is dat deze evolutionaire setting een afspiegeling is van wat we vaak zien bij patiënten met extreme genoomveranderingen zoals chromothripsis", zegt Mundlos. "Deze patiënten kunnen verbrijzelde chromosomen hebben, maar hebben nog steeds relatief milde symptomen. Dit kan worden verklaard door deze aanvullende regulerende mechanismen die schadelijke effecten compenseren door gebruik te maken van de hulpmiddelen die het genoom tot zijn beschikking heeft." + Verder verkennen
Moleculaire grenzen in DNA verkennen
 Hoe vindt u hoeveel mol in een verbinding
Hoe vindt u hoeveel mol in een verbinding  Science Fair Project over het effect van koolzuurhoudende dranken op vlees
Science Fair Project over het effect van koolzuurhoudende dranken op vlees Onderzoekers beoordelen de snelle vooruitgang in machine learning voor de chemische wetenschappen
Onderzoekers beoordelen de snelle vooruitgang in machine learning voor de chemische wetenschappen Onderzoekers geven een nieuwe draai aan moleculaire zuurstof
Onderzoekers geven een nieuwe draai aan moleculaire zuurstof Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur
Simulaties maken het mogelijk om stereochemie te kiezen voor je eigen avontuur
 Op koers voor gezonder, duurzamere bodem
Op koers voor gezonder, duurzamere bodem Hoe technologie kan bijdragen aan het behoud van het politieke momentum voor de ambities van het Akkoord van Parijs
Hoe technologie kan bijdragen aan het behoud van het politieke momentum voor de ambities van het Akkoord van Parijs Welke vliegende insecten leven in je haar, huid en huis?
Welke vliegende insecten leven in je haar, huid en huis?  Zelfs als hij in de opslag staat, steenkool bedreigt de menselijke gezondheid
Zelfs als hij in de opslag staat, steenkool bedreigt de menselijke gezondheid Zeespiegel beïnvloedt uitbarstingen op vulkanisch eiland
Zeespiegel beïnvloedt uitbarstingen op vulkanisch eiland
Hoofdlijnen
- Is de remedie tegen kanker een virus?
- Nieuw algoritme herkent duidelijke dolfijnklikken in onderwateropnamen
- Science Project on Why Bones krijgt Rubbery in Azijn
- Optimale groepsgroottes verschillen per geslacht bij coöperatieve dieren
- Wat is het voordeel van het feit dat het DNA goed is ingepakt in de chromosomen?
- Elandenpopulatie in Vermont worstelt ondanks bezuiniging op jacht
- Neurale opnames van wilde vleermuizen onthullen een unieke organisatie van het middenhersenengebied voor het volgen en vangen van prooien
- Een door kracht aangedreven mechanisme voor het vaststellen van celpolariteit
- Voorbeelden van diffusie in orgels
- Wat zijn de zes belangrijkste elementen in levende organismen?

- Snellere Salmonella-test verhoogt voedselveiligheid voor mens en dier
- De genetische handtekening van de zeeschelp lezen

- Vroege bloeiers:statistische tool onthult effecten van klimaatverandering op planten

- Hoe wordt glucose opgeslagen in plantencellen?

 Revoluties in het begrijpen van de ionosfeer, De interface van de aarde naar de ruimte
Revoluties in het begrijpen van de ionosfeer, De interface van de aarde naar de ruimte Een weegschaal gebruiken
Een weegschaal gebruiken Hoe Mushroom Spawn te maken
Hoe Mushroom Spawn te maken  Celkarakteristieken
Celkarakteristieken Atlantisch orkaanseizoen kan extreem actief zijn:NOAA
Atlantisch orkaanseizoen kan extreem actief zijn:NOAA Nieuw onderzoek bekijkt hoe het kosmische web van filamenten de stervorming in sterrenstelsels verandert
Nieuw onderzoek bekijkt hoe het kosmische web van filamenten de stervorming in sterrenstelsels verandert Wat is een oplosmiddel?
Wat is een oplosmiddel?  Hoe zuren en basen te bewaren
Hoe zuren en basen te bewaren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

