Wetenschap
Interacties tussen eenvoudige moleculaire mechanismen leiden tot complexe infectiedynamiek

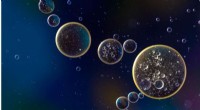
Populaties van met virussen geïnfecteerde bacteriën worden bemonsterd en geanalyseerd op petrischalen om de infectiedynamiek te bestuderen. Krediet:IST Oostenrijk/Maroš Pleška
bacteriën, die infecties veroorzaken, kunnen zelf worden geïnfecteerd door virussen die bacteriofagen worden genoemd. Net zoals niet alle bacteriën schadelijk zijn voor de mens, niet alle virussen zijn schadelijk voor bacteriën, en sommigen kunnen hen zelfs ten goede komen. Kunnen bacteriën goede en slechte virussen onderscheiden? Een interdisciplinair team van wetenschappers van het Institute of Science and Technology Austria (IST Oostenrijk) bestudeerde hoe infecties met potentieel gunstige virussen zich afspelen bij bacteriën die een bepaald type antiviraal immuunsysteem dragen, restrictie-modificatie (RM) genaamd. Ze laten zien dat interacties op populatieniveau tussen virussen en bacteriën ervoor zorgen dat de infectie verloopt op een manier die het inherente nadeel van individuele cellen compenseert en immuunbacteriën in staat stelt op de lange termijn veel meer voordelige virussen te verwerven. Dit is de bevinding van een studie gepubliceerd in Natuur Ecologie &Evolutie . Het onderzoek is uitgevoerd door Maros Pleska, een promovendus en Moritz Lang een postdoc in de groep van Celin Guet bij IST Oostenrijk, evenals medewerkers Dominik Refardt aan de Zürich University of Applied Sciences en Bruce Levin aan de Emory University.
Veel virussen repliceren eenvoudig in bacteriën, en dergelijke infecties, die meestal leiden tot de dood van de geïnfecteerde bacterie, worden lytisch genoemd. Echter, sommige virussen, zogenaamde gematigde virussen, kan een zachtere benadering aannemen:tijdens lysogene infecties, de genetische informatie van een gematigd virus integreert in de genetische informatie van de geïnfecteerde bacterie en verbetert zo het bacteriële genenrepertoire. Voorbeelden van genen, die onder bacteriën worden verspreid door gematigde virussen, bevatten gevaarlijke gifstoffen zoals shiga-toxine, cholera toxine, of botulinumtoxine. Echter, er is een vangst voor de bacteriën, omdat gematigde virussen zowel kunnen doden als integreren in hun gastheren, en de beslissing op welke manier de infectie verloopt, wordt schijnbaar willekeurig genomen.
Het is algemeen bekend dat veel bacteriën zichzelf beschermen tegen dodelijke lytische infecties door mechanismen van immuniteit, zoals restrictie-modificatie (RM) systemen die viraal DNA knippen. Wat niet bekend is, is hoe deze primitieve immuunsystemen het vermogen van bacteriën beïnvloeden om potentieel gunstige virussen te verwerven tijdens het proces van lysogenie. Kunnen RM-systemen onderscheid maken tussen lytische en lysogene infecties, of handelen ze meer in het algemeen? En terwijl bacteriën worden beschermd tegen de dood, voorkomen ze ook dat ze nuttige virussen verwerven? Pleska, Lang en hun collega's combineerden experimenten en theorie om deze vraag te onderzoeken.
Als eerste stap, de onderzoekers keken naar wat er gebeurt met individuele bacteriën die RM-systemen dragen wanneer ze worden geïnfecteerd met gematigde virussen. Ze ontdekten dat het RM-systeem altijd probeerde infectie te voorkomen, ongeacht of de infectie op weg was naar lysis of lysogenie. Van dit, de conclusie is dat als een onbedoelde kost om te voorkomen dat bacteriën lyseren, RM-systemen vormen ook een barrière voor de verwerving van virale genen.
Echter, een heel ander resultaat kwam naar voren toen de onderzoekers onderzochten wat er gebeurt op het niveau van de bacteriepopulatie. Ze vermengden een groot aantal bacteriën met een groot aantal bacteriofagen, en bekeken hoeveel bacteriën op lange termijn virale genen kregen. Op basis van het vorige resultaat, de wetenschappers verwachtten dat virussen veel minder vaak zouden integreren in bacteriën met RM-systemen, in vergelijking met bacteriën zonder dit immuniteitsmechanisme. Echter, het tegenovergestelde gebeurde - er waren meer virussen geïntegreerd in bacteriën waarvan werd verwacht dat ze immuun waren.
Restrictie-modificatiesystemen bieden tijdelijk uitstel
Wat is de verklaring van dit contra-intuïtieve resultaat? De onderzoekers ontdekten dat in plaats van infecties volledig te voorkomen, RM-systemen stellen de infectie alleen maar uit, waardoor de bacteriepopulatie de tijd krijgt om te groeien totdat virussen de barrière doorbreken en de infectie volledig toeslaat. Hoewel lysis vaker voorkomt in kleine bacteriepopulaties en veel bacteriën worden gedood als de populatie vroeg wordt geïnfecteerd, lysogenie komt vaker voor in grote bacteriële populaties, waardoor bacteriën die later geïnfecteerd raken, meer kans hebben om het virus te krijgen in plaats van erdoor te worden gedood. RM-systemen bieden daarom een tijdelijk uitstel, bacteriële populaties alleen beschermen tegen de gevaarlijkste fase van infectie, zonder de potentiële voordelen te beperken.
Is een nieuw onbekend moleculair mechanisme verantwoordelijk voor deze gedragsverandering? Nee, zegt eerste auteur Maros Pleska:"De meest intrigerende bevinding is dat we eigenlijk helemaal geen nieuw mechanisme hoefden te vinden. Wat we waarnemen is allemaal een eenvoudig gevolg van de populatiedynamiek van interacties tussen bacteriën en virussen."
Dit resultaat is een afwijzing voor diegenen die het gedrag van populaties op langere termijn willen voorspellen vanuit de biologie van individuele moleculaire componenten, legt Pleska uit:"De basisbiologie van alle elementen in ons systeem stond bekend als de RM-systemen en virussen die we hebben bekeken zijn enkele van de best begrepen moleculaire systemen die we kennen. Niettemin, deze studie illustreert hoe hopeloos we zijn als het gaat om het gebruik van deze kennis op moleculair niveau om de dynamiek te voorspellen die optreedt nadat we individuele stukken in elkaar hebben gezet. In feite, onze waarnemingen liepen volledig tegengesteld aan wat iemand zou verwachten. Dus, ecologische en evolutionaire interacties tussen zelfs de eenvoudigste biologische elementen kunnen zeer complex zijn en we hebben nieuwe manieren nodig om ernaar te kijken, als we ooit hun rol in de natuur willen begrijpen."
 Techniek vist waardevolle voedingsstoffen uit garnalenverwerkingswater
Techniek vist waardevolle voedingsstoffen uit garnalenverwerkingswater Spinzijde kan worden gebruikt als robotspier
Spinzijde kan worden gebruikt als robotspier Onderzoekers rapporteren snelste zuivering van astatine-211 die nodig is voor gerichte kankertherapie
Onderzoekers rapporteren snelste zuivering van astatine-211 die nodig is voor gerichte kankertherapie Besluipen op kleine kristallen met elektronendiffractie
Besluipen op kleine kristallen met elektronendiffractie Elektrolytisch gedeponeerde oppervlakken met omkeerbaar schakelende grensvlakeigenschappen
Elektrolytisch gedeponeerde oppervlakken met omkeerbaar schakelende grensvlakeigenschappen
 Hoe slecht beheer van Nigeriaanse bossen leidde tot uitbuiting door criminelen
Hoe slecht beheer van Nigeriaanse bossen leidde tot uitbuiting door criminelen Meer van Maracaibo, bliksem hoofdstad van de wereld
Meer van Maracaibo, bliksem hoofdstad van de wereld Door bosbranden is een kwart miljoen hectare verbrand
Door bosbranden is een kwart miljoen hectare verbrand Wat zijn de acht belangrijkste ecosystemen?
Wat zijn de acht belangrijkste ecosystemen?  Veranderingen veroorzaakt door verergerende bosbranden in Californische bossen zullen eeuwen duren
Veranderingen veroorzaakt door verergerende bosbranden in Californische bossen zullen eeuwen duren
Hoofdlijnen
- Update over bedreigde Filippijnse cycadsoorten
- Cytokinese: wat is het? & Wat gebeurt er in planten en dierencellen?
- Genetisch verhogen van de voedingswaarde van maïs kan miljoenen ten goede komen
- Niveaus van celorganisatie
- Onderzoekers creëren nieuwe letters om DNA-functies te verbeteren
- keratine, eiwitten van 54 miljoen jaar oude zeeschildpad vertonen evolutie van overlevingskenmerken
- Wat is de structuur van stamcellen?
- Bijen gebruiken onzichtbare warmtepatronen om bloemen te kiezen
- Wetenschappers ontdekken dat de meeste blauwe vinvissen rechtshandig zijn, behalve wanneer ze omhoog zwemmen
 Zijn voedingsmiddelen gemaakt met behulp van biotechnologie veilig om te eten?
Zijn voedingsmiddelen gemaakt met behulp van biotechnologie veilig om te eten?  Maak indruk op je date op Valentijnsdag door de punt in je hoofd te berekenen
Maak indruk op je date op Valentijnsdag door de punt in je hoofd te berekenen Klimaatverandering en de oceaan
Klimaatverandering en de oceaan Moleculen tellen met een gewone mobiele telefoon
Moleculen tellen met een gewone mobiele telefoon Het overwinnen van zwak bestuur zal tientallen jaren duren met gevolgen voor klimaatadaptatie
Het overwinnen van zwak bestuur zal tientallen jaren duren met gevolgen voor klimaatadaptatie Goed nieuws voor vissers:bruin worden heeft minder invloed op vissen dan verwacht
Goed nieuws voor vissers:bruin worden heeft minder invloed op vissen dan verwacht Californië klaagt aan wegens plan om emissienormen voor auto's te schrappen
Californië klaagt aan wegens plan om emissienormen voor auto's te schrappen Natuurkundigen ontwikkelen concept van nieuw snel niet-vluchtig geheugen
Natuurkundigen ontwikkelen concept van nieuw snel niet-vluchtig geheugen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com