Wetenschap
Genbewerking in de hersenen krijgt een grote upgrade
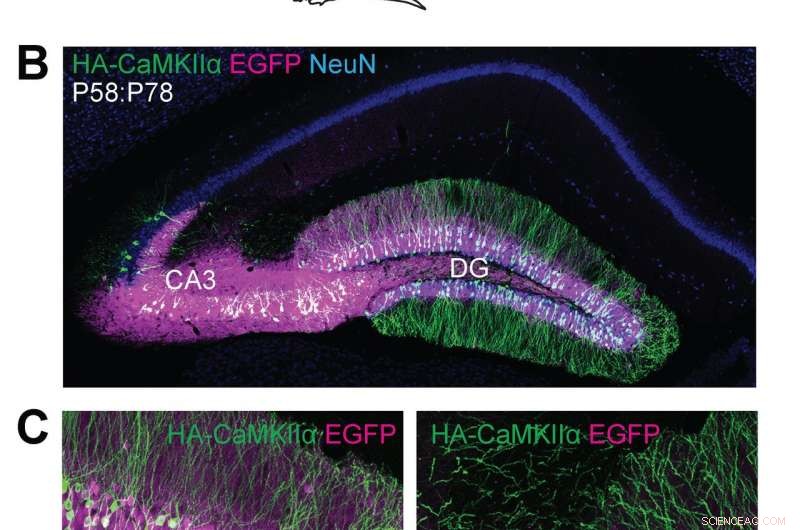
(A) Schematische illustraties van experimenten. (B, C) Confocale microscopische beelden van coronale hersensecties van de hippocampus van Cas9-muizen, met de EGFP-fluorescentie (B, C, magenta), immunoreactiviteiten voor NeuN (B, blauw) en de HA-tag (B, C, groen) gefuseerd aan de N-terminus van endogeen CaMKIIα. Krediet:Max Planck Florida Instituut voor Neurowetenschappen
Genoombewerkingstechnologieën hebben een revolutie teweeggebracht in de biomedische wetenschap, het verstrekken van een snelle en gemakkelijke manier om genen te wijzigen. Echter, de techniek waarmee wetenschappers de meest nauwkeurige bewerkingen kunnen uitvoeren, werkt niet in cellen die niet langer delen - waaronder de meeste neuronen in de hersenen. Deze technologie had beperkt gebruik in hersenonderzoek, tot nu. Onderzoeksmedewerker Jun Nishiyama, MD, doctoraat, Onderzoekwetenschapper, Takayasu Mikuni, MD, doctoraat, en wetenschappelijk directeur, Ryohei Yasuda, doctoraat aan het Max Planck Florida Institute for Neuroscience (MPFI) hebben een nieuwe tool ontwikkeld die, Voor de eerste keer, maakt nauwkeurige genoombewerking mogelijk in volwassen neuronen, het openen van enorme nieuwe mogelijkheden in neurowetenschappelijk onderzoek.
Deze nieuwe en krachtige tool maakt gebruik van de nieuw ontdekte genbewerkingstechnologie van CRISPR-Cas9, een viraal afweermechanisme dat oorspronkelijk in bacteriën werd aangetroffen. Wanneer geplaatst in een cel zoals een neuron, het CRISPR-Cas9-systeem werkt om DNA op een specifiek gerichte plaats te beschadigen. De cel herstelt vervolgens deze schade met overwegend twee tegengestelde methoden; een daarvan is niet-homologe end-joining (NHEJ), die vaak foutgevoelig zijn, en homologiegerichte reparatie (HDR), die zeer nauwkeurig is en in staat is gespecificeerde geninserties te ondergaan. HDR is de meer gewenste methode, waardoor onderzoekers flexibiliteit kunnen toevoegen, aanpassen, of verwijder genen afhankelijk van het beoogde doel.
Het was nogal een uitdaging om cellen in de hersenen over te halen om bij voorkeur gebruik te maken van het HDR-DNA-reparatiemechanisme. Oorspronkelijk werd gedacht dat HDR alleen beschikbaar was als een reparatieroute voor actief prolifererende cellen in het lichaam. Wanneer voorloper hersencellen uitgroeien tot neuronen, ze worden post-mitotische of niet-delende cellen genoemd, het volwassen brein grotendeels ontoegankelijk maken voor HDR - althans dat dachten onderzoekers eerder. Het team heeft nu aangetoond dat het mogelijk is voor post-mitotische neuronen van de hersenen om actief HDR te ondergaan, de strategie "vSLENDR (viraal gemedieerde eencellige labeling van endogene eiwitten door CRISPR-Cas9-gemedieerde homologie-gerichte reparatie)" noemen. De cruciale sleutel tot het succes van dit proces is het gecombineerde gebruik van CRISPR-Cas9 en een virus.
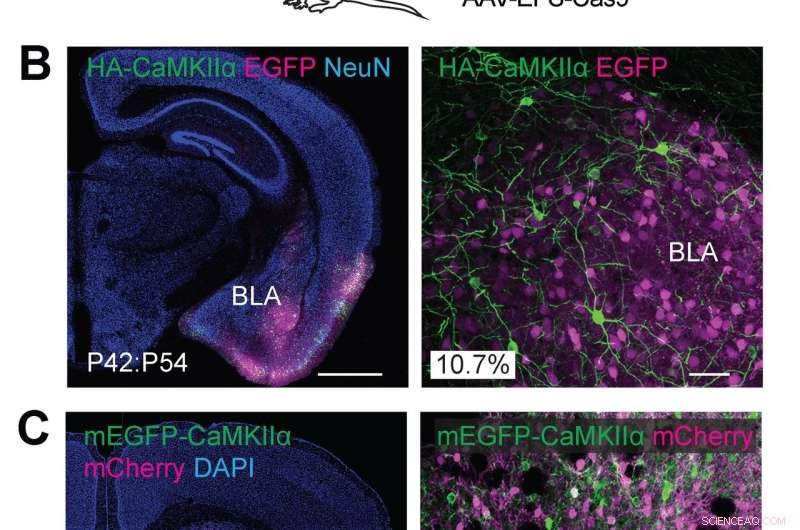
(A) Schematische illustraties van experimenten. (B) Confocale microscopische beelden van coronale hersensecties van de amygdala van wildtype muizen, met de EGFP-fluorescentie (B, magenta), immunoreactiviteiten voor NeuN (links) en de HA-tag (groen) gefuseerd met de N-terminus van endogeen CaMKIIα. (C) Confocale microscopische beelden van coronale hersensecties van het striatum van wildtype muizen, toont DAPI-signaal (links), de mCherry-fluorescentie (magenta), de mEGFP-fluorescentie (groen) gefuseerd met de N-terminus van endogeen CaMKIIα. Krediet:Max Planck Florida Instituut voor Neurowetenschappen
Adeno-geassocieerd virus (AAV) is een laag immunogeen, niet-toxisch virus dat door wetenschappers wordt gebruikt als een efficiënt leveringsmechanisme voor allerlei soorten genen. Dit virus kan effectief de donorsjabloon leveren die nodig is voor HDR, het verhogen van de efficiëntie ervan. Het team verpakte eerst de benodigde machines voor genoombewerking in de AAV en leverde deze af aan neuronen van transgene muizen die Cas9 tot expressie brengen. het bereiken van spectaculair efficiënte HDR in post-mitotische neuronen van de hersenen.
Vervolgens creëerden ze een dual-viraal systeem waarmee ze de technologie konden gebruiken bij dieren die niet waren ontworpen om Cas9 tot expressie te brengen. Ze testten dit dual-virale systeem in een muismodel met de ziekte van Alzheimer, wat aantoont dat de vSLENDR-techniek zelfs op hoge leeftijd kan worden toegepast in pathologische modellen.
vSLENDR is een krachtige nieuwe tool voor zowel basis- als translationele wetenschappen, in staat om genetische informatie nauwkeurig te bewerken, ongeacht het celtype, celrijpheid, hersengebied, of leeftijd. De nieuwe vSLENDR is efficiënter, flexibel, en beknopt, waardoor onderzoekers het potentieel hebben om een groot aantal hersenprocessen en -functionaliteiten met ongekend gemak te bestuderen. Even belangrijk is het potentiële gebruik ervan in neuropathologische ziektemodellen, het versnellen van onderzoek en de ontwikkeling van nieuwe therapieën; het vestigen van de fundamentele wetenschap van vandaag als de basis voor de behandelingen van morgen.
De studie is gepubliceerd in neuron .
 Nieuwe nanodeeltjes ontwikkeld om kanker in beeld te brengen en te behandelen
Nieuwe nanodeeltjes ontwikkeld om kanker in beeld te brengen en te behandelen Wetenschap ontmoet archeologie met ontdekking dat tandheelkundige röntgenfoto's vitamine D-tekort onthullen
Wetenschap ontmoet archeologie met ontdekking dat tandheelkundige röntgenfoto's vitamine D-tekort onthullen Video:Hoe de houdbaarheidsdatum van medicijnen werkt
Video:Hoe de houdbaarheidsdatum van medicijnen werkt Hoe de isomeren voor C6H12 te tekenen
Hoe de isomeren voor C6H12 te tekenen  Wetenschappers creëren nieuw materiaal voor elektronica van de toekomst
Wetenschappers creëren nieuw materiaal voor elektronica van de toekomst
 Biochar kan op maat worden gemaakt voor een reeks milieuvoordelen, uit onderzoek blijkt
Biochar kan op maat worden gemaakt voor een reeks milieuvoordelen, uit onderzoek blijkt Planten van de tropische savanne
Planten van de tropische savanne  Oppervlakte- en ondergrondwaterbronnen
Oppervlakte- en ondergrondwaterbronnen Wetenschapper uit Minnesota:EPA zette haar onder druk om getuigenis te veranderen
Wetenschapper uit Minnesota:EPA zette haar onder druk om getuigenis te veranderen Subsidies voor fossiele brandstoffen hebben wereldwijde hervorming nodig, zeggen experts
Subsidies voor fossiele brandstoffen hebben wereldwijde hervorming nodig, zeggen experts
Hoofdlijnen
- Hoe reproduceren protisten?
- Herbivoren helpen ecosystemen te beschermen tegen klimaatverandering
- Waarom is water belangrijk voor levende organismen?
- Hernieuwde oproepen voor legale jacht om de groeiende berenpopulatie in Connecticuts onder controle te houden
- Marmoset-baby's krijgen een boost van attente vaders
- 10 echt slimme mensen die echt domme dingen deden
- Onderzoeker onthult hoe kevers terugveren van bosbranden
- Biotechnologie en genetische manipulatie: een overzicht
- Gen-experts gaan ongediertebestrijding aanpakken
 Onderzoekers gebruiken kunstmatige neurale netwerken om het testen van materialen te stroomlijnen
Onderzoekers gebruiken kunstmatige neurale netwerken om het testen van materialen te stroomlijnen Traceerbare, met medicijnen gevulde nanodeeltjes:een potentieel wapen tegen kanker
Traceerbare, met medicijnen gevulde nanodeeltjes:een potentieel wapen tegen kanker Botten om te plukken, voor $ 8 miljoen:Stan de T rex wordt geveild
Botten om te plukken, voor $ 8 miljoen:Stan de T rex wordt geveild De relatie tussen delicate hechtdraadstructuur en dempende prestaties van biomaterialen
De relatie tussen delicate hechtdraadstructuur en dempende prestaties van biomaterialen Zuurstof in oude rotsen onthult nieuwe details van zijn eigen vroege geschiedenis op aarde
Zuurstof in oude rotsen onthult nieuwe details van zijn eigen vroege geschiedenis op aarde Computerstoring verantwoordelijk voor crash van Europese Marslander
Computerstoring verantwoordelijk voor crash van Europese Marslander Frankrijk ziet blockchain als anti-monopoliewapen in digitale wereld
Frankrijk ziet blockchain als anti-monopoliewapen in digitale wereld Verschillen tussen zinkmonomethionine en zinkpicolinaat
Verschillen tussen zinkmonomethionine en zinkpicolinaat
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com