
Wetenschap
Wetenschappers uit Praag breiden de mogelijkheden van het gebruik van RNA in de gengeneeskunde uit
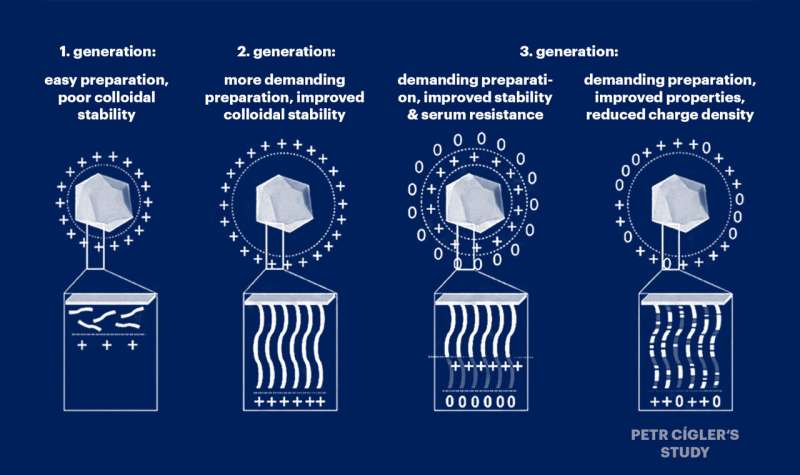
Dr. Petr Cígler en zijn medewerkers werken aan het verfijnen van moleculaire systemen voor het transporteren van ribonucleïnezuur (RNA)-moleculen naar cellen. De vraag hoe RNA effectief op een aangewezen plaats in het lichaam kan worden afgeleverd om een defect gen tot zwijgen te brengen, is een van de grootste uitdagingen op het zich snel ontwikkelende gebied van de gengeneeskunde.
Nu hebben onderzoekers van het Instituut voor Organische Chemie en Biochemie van de Tsjechische Academie van Wetenschappen (IOCB Praag) opnieuw een belangrijke stap gezet in de richting van het bereiken van dit doel. Ze hebben de bereiding van een nieuw samengesteld vector-nanomateriaal voor het transport van RNA in detail beschreven, waarbij ze zich vooral concentreerden op het garanderen van de niet-toxiciteit ervan voor cellen. De reden is dat de schadelijkheid van tot nu toe bekende nucleïnezuurvectoren een ernstig obstakel vormt voor de uitbreiding van gentherapie.
Er is een artikel over dit onderwerp gepubliceerd in Advanced Functional Materials .
Petr Cígler en zijn collega's gingen ervan uit dat de toxiciteit van nucleïnezuurvectoren wordt veroorzaakt door een overmatige accumulatie van positieve ladingen langs de ketens van dragerpolymeren die nucleïnezuren binden. Daarom verdunden ze deze positieve lading systematisch met ongeladen monomeren en ontdekten ze dat de lichte verdunning ervan het vermogen van het systeem om nucleïnezuren te transporteren niet aantastte.
In hun gedegen onderzoek beschrijven ze ook de omstandigheden waaronder nieuwe materialen kunnen worden voorbereid voor gebruik in de gengeneeskunde. De onderzoekers hebben nauwlettend gelet op de omstandigheden waarin deze stoffen nucleïnezuren het meest effectief binden en in welke stoichiometrische verhouding.
Cellen kunnen de vertaling van genen van mRNA naar eiwitten op verschillende manieren reguleren. Eén daarvan is het uitschakelen van een gen met behulp van een siRNA-molecuul (klein interfererend RNA). Dit blokkeert de productie van het doeleiwit, wat vooral nuttig is als het gen dat codeert gemuteerd of anderszins defect is. Bovendien is het mogelijk om in te grijpen als de aangeboren mechanismen van translatieregulatie verstoord zijn. In zo'n geval wordt er te veel van een eiwit in het lichaam geproduceerd, wat schadelijk is voor de gezondheid.
‘Gentherapie is niet alleen zeer effectief, maar ook acuut doelgericht. Het grootste voordeel ligt in het feit dat het nauwkeurig individuele mutaties of aandoeningen aanpakt zonder het gevaar te lopen de plank mis te slaan. Met behulp van siRNA is het mogelijk om zelfs maar één gemuteerde te raken’ letter van een gen”, zegt Marek Kindermann, de eerste auteur van het onderzoek, waarin hij de belangrijkste voordelen van gentherapie opsomt. Momenteel zijn vijf op siRNA gebaseerde medicijnen goedgekeurd voor wereldwijd gebruik, en er staan er nog een tiental op de ‘wachtlijst’.
Het therapeutisch gebruik van siRNA wordt belemmerd doordat siRNA-moleculen instabiel zijn en daardoor zeer snel in het lichaam worden afgebroken. Deskundigen over de hele wereld pakken daarom het probleem aan van hoe siRNA op een aangewezen locatie kan worden afgeleverd en het zijn werk kan doen, namelijk het stoppen of beperken van de productie van een bepaald ongewenst eiwit door het gen ervoor uit te schakelen.
Deze taak werd ook op zich genomen door het team van Petr Cígler bij IOCB Praag, samen met collega's van het Instituut voor Microbiologie van de Tsjechische Academie van Wetenschappen, onder leiding van het hoofd van de Nanomedicine-groep, Dr. Veronika Benson.
“Elk transportsysteem is ontworpen om aan twee basisdoelstellingen te voldoen:ten eerste heeft het de taak om het molecuul te beschermen tegen verval, en ten tweede moet het het transport ervan naar de cel verzekeren, zodat het het cytosol bereikt en zijn missie als cel vervult. drug daar", legt Petr Cígler uit.
"In onze studie gaan we gedetailleerd in op de eigenschappen van het transportsysteem. We dalen helemaal af tot het niveau van structurele details van moleculen die interageren met nucleïnezuren. We beschrijven de omstandigheden die nodig zijn om siRNA succesvol te laten binden aan de nanosysteem transporteren en vervolgens de intracellulaire ruimte bereiken."
Onderzoekers van IOCB Praag maken zo de weg vrij voor het gebruik van deeltjes die niet-virale vectoren worden genoemd en die geen virussen gebruiken om RNA te dragen. Ze hebben het hele transportsysteem, inclusief het nucleïnezuur, op het oppervlak van diamanten nanodeeltjes geplaatst. Dit zijn opvallend stabiele dragerdeeltjes, die bovendien een speciaal soort fluorescentie uitstralen. Dit maakt het mogelijk om hun reis door weefsels te volgen en te volgen hoe ze zich in cellen gedragen.
Een complicatie is dat het lichaam moeilijk van nanodiamanten af kan komen. Daarom is deze methode van gentherapie vooral geschikt voor de behandeling van moeilijk genezende oppervlakkige wonden. Het is voor dit soort therapieën, met de nadruk op het genezen van beenulcera bij patiënten met diabetes, dat de nieuwe transport-nanomaterialen, gepresenteerd in dit en andere werken van het team van Dr. Cígler en medewerkers, bedoeld zijn.
Hun nieuwste diepgaande studie werd mede mogelijk gemaakt dankzij het AMULET-project, dat zich richt op de ontwikkeling van nanomaterialen op meerdere schaal en acht partners samenbrengt onder leiding van het Jaroslav Heyrovský Instituut voor Fysische Chemie.