
Wetenschap
Wetenschappers betrappen planten terwijl ze de chemie veranderen, waarvan gedacht wordt dat ze onveranderlijk zijn omdat ze noodzakelijk zijn voor het leven

Voor het eerst hebben wetenschappers de celmachinerie ontdekt die een vitaal molecuul maakt in het proces van evolueren. Een belangrijk enzym dat planten gebruiken om tyrosine te maken, een aminozuur dat nodig is voor het leven, Men dacht dat het in het hele plantenrijk werd bewaard, maar de wetenschappers ontdekten dat het in peulvruchten is gemuteerd naar een andere vorm. In cherrytomaten domineert de canonieke vorm van het enzym, pinda's kunnen van slag veranderen en sommige soorten sojabonen (klonterige bonen aan de rechterkant) hebben de canonieke vorm verloren. Krediet:Jez Lab
Omdat planten niet kunnen opstaan en wegrennen, ze moesten in plaats daarvan slim zijn. Zij zijn de chemici van de levende wereld, honderdduizenden kleine moleculen produceren die ze gebruiken als zonnebrandmiddelen, planteneters te vergiftigen, om de lucht te ruiken, bloemen kleuren, en voor veel andere geheime vegetatieve zaken.
Historisch gezien zijn deze chemicaliën, genaamd "secundaire metabolieten, " zijn onderscheiden van "primaire metabolieten, " wat de bouwstenen zijn van eiwitten, vetten, suikers en DNA. Secundaire metabolieten effenen de weg in het leven, maar de primaire metabolieten zijn essentieel, en het falen om ze correct en efficiënt te maken is fataal.
Men denkt dat het secundaire metabolisme is geëvolueerd om de voorouders van planten te helpen omgaan met het leven op het droge in plaats van in de meer gastvrije oceanen. Het idee is dat de genen voor enzymen in de moleculaire assemblagelijnen van het primaire metabolisme werden gedupliceerd. De duplicaten waren toleranter voor mutaties die de primaire paden zouden hebben gedestabiliseerd omdat de originelen nog aan het werk waren. Met evolutionaire beperkingen dus versoepeld, synthetische machines waren in staat om genoeg mutaties te accumuleren om nieuwe chemie te doen.
Primair metabolisme, echter, wordt op grote schaal geconserveerd, wat betekent dat het onveranderd blijft in veel verschillende groepen organismen omdat het nauwkeurig is afgesteld om correct en efficiënt te werken en omdat zijn producten noodzakelijk zijn voor het leven. Althans, dat zeggen de leerboeken.
Maar nu heeft een samenwerkend team van wetenschappers het primaire metabolisme op heterdaad betrapt. In een uitgebreide studie van een assemblagelijn voor het primaire metabolisme in planten, ze ontdekten een sleutelenzym dat evolueerde van een canonieke vorm die de meeste planten bezitten, door niet-canonieke vormen in tomaten, naar een schakel-hitting vorm gevonden in pinda's, en uiteindelijk toe te geven aan de nieuwe vorm in sommige soorten sojabonen.
Deze prestatie, vergelijkbaar met het onder de borden uittrekken van het tafelkleed zonder ze te breken, wordt beschreven in het nummer van 26 juni van: Natuur Chemische Biologie . Het is het werk van een samenwerking tussen het Maeda-lab van de Universiteit van Wisconsin, die al lang interesse heeft in deze biochemische route, en het Jez-lab aan de Washington University in St. Louis, die het soja-enzym kristalliseerde om te onthullen hoe de natuur de werking van het eiwit veranderde.
"Het werk legt planten vast die bezig zijn met het bouwen van een pad dat het primaire met het secundaire metabolisme verbindt, " zei Joseph Jez, de Howard Hughes Medical Institute Professor in de afdeling Biologie in Arts &Sciences. "We zien eindelijk hoe evolutie de machine creëert om nieuwe moleculen te maken."
Het kan ook van praktisch belang zijn omdat de oude en de nieuwe routes het aminozuur tyrosine, dat een voorloper is voor veel secundaire metabolieten met biologische en farmaceutische activiteit - alles van vitamine E tot opioïden. Maar de oude route maakt slechts kleine hoeveelheden van deze verbindingen, deels omdat ze moeten concurreren om koolstofatomen met het hebzuchtige proces om lignine te maken, de taaie polymeren die ervoor zorgen dat planten overeind blijven staan.
De ontdekking van de nieuwe route voor het maken van tyrosine is veel minder beperkt dan de oude. Dit verhoogt de mogelijkheid dat de koolstofstroom weg van lignine kan worden geleid, het verhogen van de opbrengsten van medicijnen of voedingsstoffen tot niveaus die het mogelijk maken om ze in commerciële hoeveelheden te produceren.
Een verhaal van twee enzymen
Tyrosine wordt gemaakt op een lopende band die het shikimate-pad wordt genoemd, een metabolische route in zeven stappen die planten gebruiken om de drie aminozuren met aromatische ringen te maken. Dieren (inclusief mensen) verliezen het vermogen om deze lopende band op te richten diep in het evolutionaire verleden. Omdat we deze aminozuren niet zelf kunnen maken en ze essentieel zijn voor het leven, we moeten ze in plaats daarvan verkrijgen door planten of schimmels te eten.
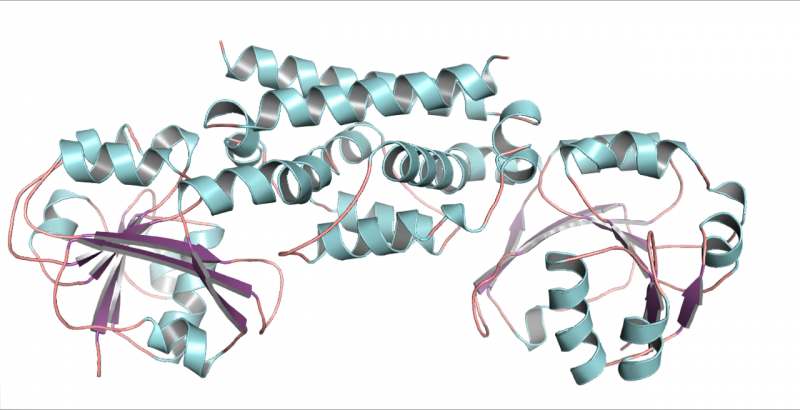
Een driedimensionale structuur van het PDH-enzym uit soja, een peulvrucht. Deze structuur hielp aantonen dat slechts één mutatie peulvruchten in staat stelde een nieuwe manier te ontwikkelen om het aminozuur tyrosine te maken. Krediet:Craig Schenck
Die aromatische ring is belangrijk, zei Jez, omdat het een onderscheidende structuur is die licht of energie kan absorberen. De aromatische aminozuren zijn dus ook de voorlopers van veel secundaire metabolieten die licht opvangen, elektronen overbrengen, of kleur bloemen. Bovendien, de aromatische aminozuren zijn ook voorlopers van chemicaliën die andere planten of plantenroofdieren vergiftigen en bestuivers aantrekken. Veel medicijnen bevatten een aromatische ring, zei Jez.
In de meeste planten bevindt de shikimaatroute zich in de chloroplast, het organel dat het werk doet om de energie van zonlicht om te zetten in energie die is opgeslagen in koolstofbindingen. Eenmaal gemaakt, echter, tyrosine kan uit het cytosol worden geëxporteerd voor opname of omzetting in andere verbindingen.
In de laatste stap van een tak van de route wordt een enzym genaamd arogenaatdehydrogenase (ADH) katalyseert een reactie waardoor de verbinding arogeneert tot tyrosine. Het ADH-enzym wordt als "regulerend" beschouwd omdat het een knelpunt is bij de productie van tyrosine. Het moet concurreren om het arogenaatsubstraat met de tak van de shikimaatroute die een ander aromatisch aminozuur maakt en het wordt sterk geremd door de opbouw van tyrosine
ADH-activiteit komt veel voor in planten, maar tijdens het bestuderen van de shikimaat-route ontdekte het Maeda-lab dat de DNA-sequenties die coderen voor ADH in sommige bloeiende planten significant verschilden van die in de meeste planten. Ze noemden de enzymen die door deze sequenties worden geproduceerd, niet-canonieke ADH. Vervolgens, in 2014, ze meldden dat sommige peulvruchten ook tyrosine maken met een ander enzym, prefenaatdehydrogenase (PDH) genoemd.
PDH verschilt in veel opzichten van ADH. Het is actief buiten de chloroplast, het werkt op het substraat prefenaat in plaats van op arogenaat, omdat het zich buiten de chloroplast bevindt, hoeft het niet te concurreren om zijn substraat met andere takken van de shikimaat-route, en het wordt niet geremd door stijgende niveaus van tyrosine.
Waarom zijn er twee verschillende assemblagelijnen voor tyrosine? De wetenschappers geloven dat het PDH-enzym is geëvolueerd via twee genduplicatiegebeurtenissen en de accumulatie van mutaties in de "extra" kopieën van het gen. De eerste gebeurtenis leidde tot niet-standaard ADH's in sommige bloeiende planten en de tweede tot PDH in een subset van peulvruchten. Maar waarom is dit gebeurd?
Dat is een vraag die de wetenschappers nog niet kunnen beantwoorden, behalve in algemene termen, zei Jez. Wat valt op, echter, is dat de meer recentelijk ontwikkelde metabole route niet strak gereguleerd is en mogelijk in een hectisch tempo producten zou kunnen produceren. Misschien hadden de peulvruchten om de een of andere reden dringend behoefte aan secundaire metabolieten. Het is zeker verdacht dat peulvruchten een heel andere ecologie hebben dan andere planten, omdat ze in symbiose leven met stikstofbindende bacteriën.
Friemelen aan de stukjes
Op dit punt wisten de wetenschappers dat het nieuwe enzym, PDH, gebonden aan een ander substraat dan het oorspronkelijke enzym, ADH. Ze wisten ook dat PDH, in tegenstelling tot ADH, bindt tyrosine zelf niet. Maar welke veranderingen in structuur leidden tot deze verschillen in chemische activiteit?
Er achter komen, Craig Schenck, een afgestudeerde student in het Maeda-lab, vergeleek de gensequenties voor het ADH- of PDH-enzym in veel verschillende planten, zorgvuldig gekozen om op de grens van de omschakeling van het ene enzym naar het andere te zitten. Maar ze stuitten op een probleem. Er waren genoeg verschillen in het DNA dat het moeilijk was om te zien wat relevant was, zei Jez.
Maeda ontmoeten op een conferentie, Jez bood aan om te proberen de nieuwe enzymen te kristalliseren, zodat hun structuur kon worden gereconstrueerd uit röntgenfoto's. Zijn afstudeerstudent Cynthia Holland was in staat om de sojaboon PDH te kristalliseren en gedetailleerde beelden te maken van zijn driedimensionale vorm.
"Toen je eenmaal naar de structuur keek, kon je zien dat er slechts twee verschillen waren met de typische ADH die in de meeste planten wordt gevonden en dat slechts één van de verschillen dingen echt heeft veranderd, " Zei Jez. Verbazingwekkend dat verschil was een enkel aminozuur in de actieve plaats van het enzym. Op die plek had de asparagine het asparaginezuur vervangen.
Schenck controleerde dit structurele inzicht dubbel door dat aminozuur om te draaien in gemuteerde vormen van het enzym. De ADH-mutant bleek PDH-activiteit te hebben, en de PDH-mutant had ADH-activiteit, precies zoals het team had vermoed.
"Dat ene verschil verandert het voorkeurssubstraat van het enzym en zijn vermogen om te worden geremd door tyrosinefeedback, " zei Jez. "En als je ernaar kijkt, het is letterlijk het verschil tussen een stikstofatoom of een zuurstofatoom. In deze eiwitten die zijn opgebouwd uit bijna driehonderd aminozuren of tweeënveertighonderd atomen, één atoom maakt het verschil. Dat is gewoon een beetje cool."
Het werk is belangrijk omdat het aantoont dat het primaire metabolisme evolueert. En omdat het laat zien hoe de natuur machines steelt van het primaire metabolisme en het samenvoegt om nieuwe secundaire metabolieten te maken. Ze doen dit met veel meer finesse dan genetische ingenieurs tot nu toe aankunnen.
"Als we willen dat een plant een nieuw molecuul maakt, "Jez zei, "We laten een gen vallen en hopen dat het integreert met bestaande paden. We weten nog steeds niet hoe we de bedrading gemakkelijk kunnen verbinden tussen wat we binnenlaten en wat er al is. Het is dus interessant om te zien hoe de natuur het heeft bedacht om de bedrading te verbinden en dingen veranderen zonder ze te breken."
 Onderzoekers sturen DNA op sequentiële bouwmissie
Onderzoekers sturen DNA op sequentiële bouwmissie Staatsonderzoekers Sam Houston bestuderen DNA van explosieven
Staatsonderzoekers Sam Houston bestuderen DNA van explosieven Video:Zal het cryogeen bevriezen en weer tot leven komen ooit werkelijkheid worden?
Video:Zal het cryogeen bevriezen en weer tot leven komen ooit werkelijkheid worden? Wat voor soort reactie komt er met waterstofchloride en Alka Seltzer?
Wat voor soort reactie komt er met waterstofchloride en Alka Seltzer?  Wat zijn alfa-, bèta- & gamma-deeltjes?
Wat zijn alfa-, bèta- & gamma-deeltjes?
 Rechter stopt bouw Dakota Access-pijpleiding niet
Rechter stopt bouw Dakota Access-pijpleiding niet Burgers geven de voorkeur aan landschappen die natuur combineren met gebouwde infrastructuur
Burgers geven de voorkeur aan landschappen die natuur combineren met gebouwde infrastructuur Hoge golf overstromingen in West Maui voorspeld via nieuwe online tool
Hoge golf overstromingen in West Maui voorspeld via nieuwe online tool Amerikaanse wetenschappers bestuderen de impact van uranium in de Grand Canyon-regio
Amerikaanse wetenschappers bestuderen de impact van uranium in de Grand Canyon-regio De combinatie van waterschaarste en een starre vraag brengt de stroomgebieden van de wereld in gevaar
De combinatie van waterschaarste en een starre vraag brengt de stroomgebieden van de wereld in gevaar
Hoofdlijnen
- Verschil tussen plant- en diercelafdeling
- Parasieten en gastheren kunnen anders reageren op een warmere wereld
- Geen herten meer in de koplamp:onderzoek toont aan dat grote zoogdieren wel gebruik maken van wegkruisingsconstructies
- Studie van keverflagellum biedt mogelijke manier om medische hulpmiddelen te verbeteren
- Brandende chili houdt olifanten op afstand, nieuwe studie vondsten
- Een mogelijke verklaring voor hoe kiemlijnen worden verjongd
- Onderzoekers lokaliseren genetische mutatie bij chronische nachtbrakers
- Terugkeer van de inheemse wilde kalkoen - duurzame oogstdoelen stellen wanneer de informatie beperkt is
- Hoe Agarose Gel te interpreteren
- Mijn ambitie? Nog een Nobelprijs zegt scheikunde laureaat

- Onderzoekers ontdekken dat zaadvliezen kunnen leiden tot sterke, moeilijk, maar toch flexibele materialen

- een nieuwe, natuurlijke wascoating maakt kleding waterafstotend en ademend

- Een betere koolstofvanger haalt broeikasgassen uit de lucht en zet ze in gebruik
- Enkele moleculen vastgelegd op video met een ongekende 1, 600 beelden per seconde

 Fiji zet zich schrap voor cycloon Sarai
Fiji zet zich schrap voor cycloon Sarai Hoe heeft Lake Nyos plotseling 1 gedood
Hoe heeft Lake Nyos plotseling 1 gedood  Geen belasting op CO2-uitstoot in nieuwe Chinese milieuwet
Geen belasting op CO2-uitstoot in nieuwe Chinese milieuwet Wetenschappers ontwikkelen techniek om stralingsschade over een quadriljoenste van een seconde waar te nemen
Wetenschappers ontwikkelen techniek om stralingsschade over een quadriljoenste van een seconde waar te nemen Snakes & Spiders in Santa Fe, New Mexico
Snakes & Spiders in Santa Fe, New Mexico  Hoe Neanderthalers de menselijke genetica beïnvloedden op het kruispunt van Azië en Europa
Hoe Neanderthalers de menselijke genetica beïnvloedden op het kruispunt van Azië en Europa Waarom is stuifmeel belangrijk?
Waarom is stuifmeel belangrijk?  Disk Detective heeft jouw hulp nodig bij het vinden van schijven waar planeten zich vormen
Disk Detective heeft jouw hulp nodig bij het vinden van schijven waar planeten zich vormen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

