
Wetenschap
Wetenschappers ontwikkelen nieuwe techniek om cellen en weefsels onder de huid in beeld te brengen
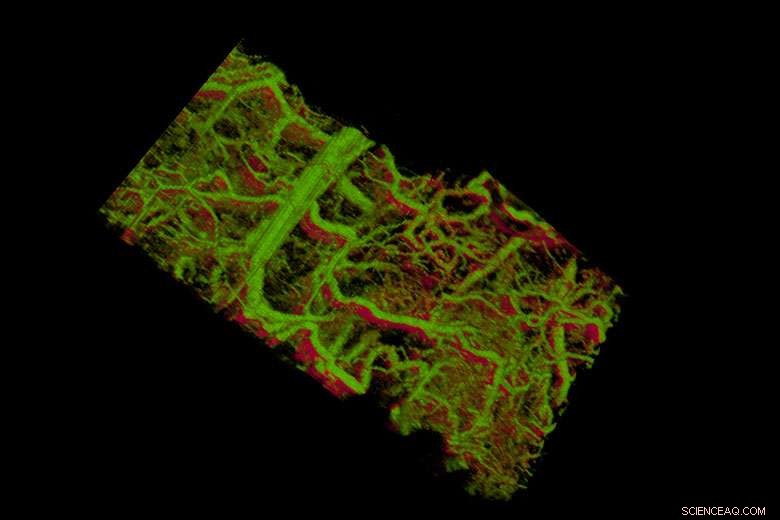
Gouden nanostaafjes in de bloedvaten van een muisoor lijken groen. Rechtsonder zie je bloedvaten in een tumor die onder de huid ligt. Krediet:het la Zerda-lab
Wetenschappers hebben veel hulpmiddelen tot hun beschikking om geconserveerd weefsel onder een microscoop in ongelooflijk detail te bekijken, of turen in het levende lichaam met een lagere resolutie. Wat ze niet hebben gehad, is een manier om beide te doen:een driedimensionaal realtime beeld creëren van individuele cellen of zelfs moleculen in een levend dier.
Nutsvoorzieningen, Stanford-wetenschappers hebben de eerste glimp onder de huid van een levend dier gegeven, met ingewikkelde realtime details in drie dimensies van de lymfe en bloedvaten.
De techniek, MOZART genoemd (voor moleculaire beeldvorming en karakterisering van weefsel op niet-invasieve wijze bij cellulaire resolutie), zou wetenschappers ooit in staat kunnen stellen tumoren in de huid te detecteren, dikke darm of slokdarm, of zelfs om de abnormale bloedvaten te zien die verschijnen in de vroegste stadia van maculaire degeneratie - een belangrijke oorzaak van blindheid.
"We hebben geprobeerd in het levende lichaam te kijken en informatie te zien op het niveau van de enkele cel, " zei Adam de la Zerda, een assistent-professor structurele biologie aan Stanford en senior auteur op het papier. "Tot nu toe was er geen manier om dat te doen."
De la Zerda, die ook lid is van Stanford Bio-X, zei dat de techniek artsen in staat zou kunnen stellen om te volgen hoe een anders onzichtbare tumor onder de huid reageert op de behandeling, of om te begrijpen hoe individuele cellen loskomen van een tumor en naar verre locaties reizen.
Voor goud gaan
Er bestaat een techniek om enkele millimeters onder de huid in een levend weefsel te gluren, het onthullen van een landschap van cellen, weefsels en vaten. Maar die techniek, optische coherentietomografie genoemd, of OCT, niet gevoelig of specifiek genoeg is om de individuele cellen of de moleculen te zien die de cellen produceren, dat is wat de la Zerda interesseert.
Een belangrijk probleem was het vinden van een manier om onderscheid te maken tussen cellen of weefsels; bijvoorbeeld, het uitkiezen van de kankercellen die zich beginnen te vermenigvuldigen in een algeheel gezond weefsel. Bij andere vormen van microscopie, wetenschappers hebben tags gemaakt die zich vastklampen aan moleculen of structuren van belang om die structuren te verlichten en een gedetailleerd beeld te geven van waar ze zich in de cel of het lichaam bevinden.
Dergelijke bakens bestonden niet voor LGO, hoewel de la Zerda wist dat kleine deeltjes, gouden nanostaafjes genaamd, enkele van de eigenschappen hadden waarnaar hij op zoek was. Het probleem was dat de in de handel verkrijgbare nanostaafjes lang niet genoeg signaal produceerden om in een weefsel te worden gedetecteerd.
Wat het team nodig had, waren nanostaafjes, maar grote. Nanostaafjes zijn analoog aan orgelpijpen, zei afgestudeerde student Elliott SoRelle, omdat langere pijpen trillen bij lagere frequenties, het creëren van een diepe, laag geluid. Hetzelfde, langere nanostaafjes trillen bij lagere frequenties, of golflengten, van licht. Die trillingen verstrooien het licht, die de microscoop detecteert.
Als alle andere weefsels trillen in een witte ruis van hogere frequenties, langere nanostaafjes zouden opvallen als lage orgeltonen in een kamer van gebabbel.
De uitdaging van SoRelle was om langere nanostaafjes te maken die niet-toxisch waren, stabiel en zeer helder, wat veel gevraagd bleek te zijn. "Mijn achtergrond was biochemie, en dit bleek een probleem te zijn van materiaalwetenschap en oppervlaktechemie, " zei SoRelle, die co-eerste auteur op het papier was. Hij kan nu niet-toxische nanostaafjes maken in verschillende maten die allemaal trillen op unieke en herkenbare frequenties.
Ruis elimineren
De volgende uitdaging was het filteren van de frequentie van de nanostaafjes uit het omringende weefsel.
Om dat te doen, Afgestudeerde elektrotechniek en Bowes Bio-X Fellow Orly Liba ontwikkelde computeralgoritmen die de frequenties van het licht dat wordt verstrooid door nanostaafjes van verschillende lengtes kunnen scheiden en die van het omringende weefsel kunnen onderscheiden.
Met SoRelle's grote nanostaafjes en Liba's gevoelige algoritmen, de la Zerda en zijn team hadden het oorspronkelijke probleem opgelost van het detecteren van specifieke structuren in driedimensionale afbeeldingen van levende weefsels. De resulterende driedimensionale, afbeeldingen met een hoge resolutie waren zo groot - in de orde van gigapixels - dat het team extra algoritmen moest ontwikkelen om zulke grote afbeeldingen te analyseren en op te slaan.
Het team testte hun technologie in het oor van een levende muis, waar ze konden toekijken hoe de nanostaafjes in het lymfesysteem werden opgenomen en door een netwerk van kleppen werden getransporteerd. Ze waren in staat onderscheid te maken tussen twee nanostaafjes van verschillende grootte die resoneerden op verschillende golflengten in afzonderlijke lymfevaten, en ze konden onderscheid maken tussen die twee nanostaafjes in het lymfesysteem en de bloedvaten. In een studie, ze konden individuele kleppen in de lymfevaten zien openen en sluiten om de vloeistofstroom in één richting te regelen.
"Niemand heeft dat detailniveau eerder getoond, " zei Liba, die co-eerste auteur op het papier was.
Onmogelijk doel
Deze gedetailleerde beeldvorming was het eerste doel van De la Zerda toen hij in 2012 zijn laboratorium begon. hoewel hem vaak werd verteld dat het onmogelijk zou zijn. "Ik zit op een kleine afdeling, maar met een zeer bekwaam vermogen, " zei hij. "Een lid van de faculteit vertelde me zijn eigen levensverhaal over het nemen van grote risico's en dat moedigde me aan. Ik dacht dat het heel leuk zou zijn om te zien of we het kunnen laten werken en cellen in realtime met elkaar kunnen zien praten."
Zijn gok kwam voornamelijk van de grond met een seed-subsidie van Stanford Bio-X, die interdisciplinair onderzoek in een vroeg stadium ondersteunt. "Die subsidie stelde ons in staat een groot risico te nemen in een richting die volledig onbewezen was, ' zei de la Zerda.
Na te hebben aangetoond dat de gouden nanostaafjes te zien zijn in levend weefsel, de volgende stap is om aan te tonen dat die nanostaafjes kunnen binden aan specifieke soorten cellen, zoals huidkanker of abnormale bloedvaten in een vroeg stadium van maculaire degeneratie. Vervolgens, de techniek zou kunnen worden gebruikt om meer te weten te komen over het verloop van die ziekten op moleculair niveau en ook om behandelingen bij individuele patiënten te evalueren, iets wat voorheen niet mogelijk was.
 De multitasking-katalysator
De multitasking-katalysator Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank
Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank Structuurmotiefgericht leerkader voor anorganische kristallijne systemen
Structuurmotiefgericht leerkader voor anorganische kristallijne systemen Ontdekking van poreuze vloeistof leidt tot nieuw spin-outbedrijf
Ontdekking van poreuze vloeistof leidt tot nieuw spin-outbedrijf Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen
Geminiaturiseerde neuroprobe voor het nemen van monsters van neurotransmitters in de hersenen
 klimaatverandering, bosverlies en branden:wetenschappers leggen uit hoe het Amazonewoud in een vicieuze cirkel zit
klimaatverandering, bosverlies en branden:wetenschappers leggen uit hoe het Amazonewoud in een vicieuze cirkel zit Wat is het doel van dierproeven?
Wat is het doel van dierproeven?  Turfuitbreiding in de Arctische toendra zou een rol kunnen spelen bij het afkoelen van een opwarmende planeet
Turfuitbreiding in de Arctische toendra zou een rol kunnen spelen bij het afkoelen van een opwarmende planeet Hoe wordt een blizzardstorm gevormd?
Hoe wordt een blizzardstorm gevormd?  Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Bestrijding van 18 branden, Californië kan het ergste brandseizoen tegemoet gaan
Hoofdlijnen
- Hartmonitors op wilde narwallen onthullen alarmerende reacties op stress
- Ecologische niche: definitie, soorten, belang en voorbeelden
- Bestaat er zoiets als een werkelijk onzelfzuchtige daad?
- Welke drie organellen hebben DNA?
- Drie mechanismen van genetische recombinatie in prokaryoten
- Wanneer wordt een mutatie in een DNA-molecuul doorgegeven aan nakomelingen?
- Honden likken hun mond om te communiceren met boze mensen
- Stichting om speciaal reservaat te creëren voor albino orang-oetan
- Een fokprogramma voor natuurbehoud opzetten om de laatste saola te redden
- Sensor detecteert glucose in speeksel en tranen voor diabetestest
- Gedrukte elektronica opent weg voor geëlektrificeerde tatoeages en gepersonaliseerde biosensoren

- Hier is een tip:Ingesprongen cement vertoont unieke eigenschappen

- Nanodeeltjes creëren warmte uit licht om elektrische activiteit in neuronen te manipuleren
- De longen kunnen eronder lijden wanneer bepaalde elementen nano gaan

 Enkele moleculen kunnen werken als reproduceerbare transistoren - bij kamertemperatuur
Enkele moleculen kunnen werken als reproduceerbare transistoren - bij kamertemperatuur Wacht niet op een eenhoorn:nu investeren in koolstofarme technologie bespaart geld
Wacht niet op een eenhoorn:nu investeren in koolstofarme technologie bespaart geld NASA betrapt tropische stormdolfijn die naar het noorden zwemt
NASA betrapt tropische stormdolfijn die naar het noorden zwemt Showtime voor Stadia-cloudgamingservice
Showtime voor Stadia-cloudgamingservice Gadgets:versterkte antenne, eenvoudig in te stellen, voegt lokale zenders toe
Gadgets:versterkte antenne, eenvoudig in te stellen, voegt lokale zenders toe Doorzichtige film verwerpt 70 procent van de binnenkomende zonnewarmte
Doorzichtige film verwerpt 70 procent van de binnenkomende zonnewarmte Hoe Duitsland uiteindelijk de lichten uitdoet in de zwarte kolenmijn
Hoe Duitsland uiteindelijk de lichten uitdoet in de zwarte kolenmijn De stille zon is veel actiever dan we dachten:studeren
De stille zon is veel actiever dan we dachten:studeren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

