
Wetenschap
Stoornis is de sleutel tot het mysterie van nanobuisjes
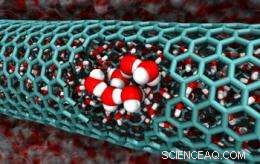
Deze afbeelding van de simulaties van het Caltech-team toont een uitsnede van een koolstofnanobuis met een diameter van 2,0 nanometer, het onthullen van opgesloten watermoleculen. [Tegoed:Caltech/Tod Pascal]
Wetenschappers vinden vaak vreemde en onverwachte dingen als ze kijken naar materialen op nanoschaal - het niveau van afzonderlijke atomen en moleculen. Dit geldt zelfs voor de meest voorkomende materialen, zoals water.
Voorbeeld:in de afgelopen paar jaar onderzoekers hebben waargenomen dat water spontaan in extreem kleine buisjes van grafiet of grafeen stroomt, koolstofnanobuisjes genoemd. Deze onverwachte waarneming is intrigerend omdat koolstofnanobuizen veelbelovend zijn in de opkomende gebieden van nanofluïdica en nanofiltratie, waar nanobuisjes kunnen helpen kleine stromen te behouden of onzuiverheden van water te scheiden. Echter, niemand is erin geslaagd uit te leggen waarom, op moleculair niveau, een stabiele vloeistof zou zich tot zo'n klein gebied willen beperken.
Nutsvoorzieningen, een nieuwe methode gebruiken om de dynamiek van watermoleculen te berekenen, Caltech-onderzoekers denken dat ze het mysterie hebben opgelost. Het blijkt dat entropie, een meting van wanorde, is de ontbrekende sleutel geweest.
"Het is een vrij verrassend resultaat, " zegt William Goddard, de Charles en Mary Ferkel hoogleraar scheikunde, Materiaal kunde, en Applied Physics bij Caltech en directeur van het Materials and Process Simulation Center. "Mensen richten zich normaal gesproken op energie in dit probleem, geen entropie."
Dat komt omdat water een uitgebreid netwerk van waterstofbruggen vormt, wat hem erg stabiel maakt. Het doorbreken van die sterke interacties kost energie. En aangezien sommige bindingen moeten worden verbroken om water in kleine nanobuisjes te laten stromen, het lijkt onwaarschijnlijk dat water dat vrijelijk zou doen.
"Wat we ontdekten, is dat het eigenlijk een afweging is, Goddard zegt. "Je verliest een deel van die goede energiestabilisatie door de binding, maar in het proces win je aan entropie."
Entropie is een van de drijvende krachten die bepalen of een proces spontaan zal plaatsvinden. Het vertegenwoordigt het aantal manieren waarop een systeem in een bepaalde staat kan bestaan. Hoe meer arrangementen beschikbaar zijn voor een systeem, hoe groter de wanorde, en hoe hoger de entropie. En in het algemeen, de natuur gaat in de richting van wanorde.
Wanneer water ideaal gebonden is, alle waterstofbruggen houden de moleculen op hun plaats, hun vrijheid beperken en de entropie van water laag houden. Wat Goddard en postdoctoraal geleerde Tod Pascal ontdekten, is dat in het geval van sommige nanobuisjes, water krijgt voldoende entropie door de buizen binnen te gaan om op te wegen tegen de energieverliezen die worden veroorzaakt door het verbreken van enkele van zijn waterstofbruggen. Daarom, water stroomt spontaan in de buizen.
Goddard en Pascal leggen hun bevindingen uit in een artikel dat onlangs is gepubliceerd in de Proceedings van de National Academy of Sciences (PNAS) . Ze keken naar koolstofnanobuisjes met een diameter tussen 0,8 en 2,7 nanometer en vonden drie verschillende redenen waarom water vrij in de buisjes zou stromen. afhankelijk van de diameter.
Voor de kleinste nanobuisjes - die tussen de 0,8 en 1,0 nanometer in diameter - zijn de buisjes zo minuscuul dat watermoleculen er bijna een enkele rij in vormen en een gasachtige toestand aannemen. Dat betekent dat de normale gebonden structuur van vloeibaar water afbreekt, waardoor de moleculen meer bewegingsvrijheid krijgen. Deze toename in entropie trekt water in de buizen.
Op het volgende niveau, waar de nanobuisjes een diameter hebben tussen 1,1 en 1,2 nanometer, opgesloten watermoleculen rangschikken zich in gestapelde, ijsachtige kristallen. Goddard en Pascal vonden zulke nanobuisjes de perfecte maat - een soort Goudlokje-match - om gekristalliseerd water op te vangen. Deze kristalbindende interacties, geen entropie, maken het gunstig voor water om in de buizen te stromen.
Op de grootste bestudeerde schaal - met buizen waarvan de diameter nog steeds slechts 1,4 tot 2,7 nanometer breed is - ontdekten de onderzoekers dat de opgesloten watermoleculen zich meer als vloeibaar water gedragen. Echter, alweer, sommige van de normale waterstofbruggen zijn verbroken, dus de moleculen vertonen meer bewegingsvrijheid in de buizen. En de winst in entropie compenseert ruimschoots het verlies aan waterstofbindingsenergie.
Omdat de binnenkant van de koolstofnanobuisjes veel te klein is voor onderzoekers om experimenteel te onderzoeken, Goddard en Pascal bestudeerden de dynamiek van de opgesloten watermoleculen in simulaties. Met behulp van een nieuwe methode ontwikkeld door de groep van Goddard met een supercomputer, ze konden de entropie voor de afzonderlijke watermoleculen berekenen. Vroeger, dergelijke berekeningen zijn moeilijk en zeer tijdrovend geweest. Maar de nieuwe aanpak het tweefasige thermodynamische model genoemd, heeft de bepaling van entropiewaarden relatief eenvoudig gemaakt voor elk systeem.
"De oude methoden hadden acht jaar computerverwerkingstijd nodig om tot dezelfde entropieën te komen die we nu in 36 uur krijgen, ' zegt Godard.
Het team voerde ook simulaties uit met een alternatieve beschrijving van water - een beschrijving waarin water zijn gebruikelijke energie-eigenschappen had, dichtheid, en viscositeit, maar miste zijn karakteristieke waterstofbinding. In dat geval, water wilde niet in de nanobuisjes stromen, aanvullend bewijs leveren dat de van nature voorkomende lage entropie van water als gevolg van uitgebreide waterstofbinding ertoe leidt dat het spontaan koolstofnanobuisjes vult wanneer de entropie toeneemt.
Goddard gelooft dat koolstofnanobuisjes kunnen worden gebruikt om supermoleculen te ontwerpen voor waterzuivering. Door poriën met dezelfde diameters als koolstofnanobuisjes op te nemen, hij denkt dat er een polymeer gemaakt kan worden om water uit de oplossing te zuigen. Een dergelijke potentiële toepassing wijst op de noodzaak van een beter begrip van watertransport door koolstofnanobuisjes.
 Recordjaar voor Franse champagne bemoedigt druiventelers niet
Recordjaar voor Franse champagne bemoedigt druiventelers niet Oceanen kunnen een minder efficiënte koolstofput worden
Oceanen kunnen een minder efficiënte koolstofput worden Oude luchtfoto's kunnen helpen om gletsjerveranderingen te volgen, studie toont
Oude luchtfoto's kunnen helpen om gletsjerveranderingen te volgen, studie toont Wetenschappers identificeren hotspots van kustrisico's in Latijns-Amerika en het Caribisch gebied
Wetenschappers identificeren hotspots van kustrisico's in Latijns-Amerika en het Caribisch gebied VN bevestigt 18,3C recordhitte op Antarctica
VN bevestigt 18,3C recordhitte op Antarctica
Hoofdlijnen
- Embryonale ontwikkeling van een kikker
- Onderzoekers brengen dramatische achteruitgang in genetische diversiteit van noordwestelijke zalm in kaart
- Het overdrachtspotentieel van vliegen kan groter zijn dan gedacht, onderzoekers zeggen:
- Hoe honden en katten hun dag in de rechtbank kunnen krijgen
- Groene Brexit laten werken voor landbouw en milieu
- Wat zijn de functies van glazen schuif- en afdekglaasjes?
- Hebben garnalen een zenuwstelsel?
- Opkomende ziekte brengt Noord-Amerikaanse kikkers verder in gevaar
- Studie vindt hoe de overlevingstijd van stamcellen kan worden verlengd
- Een leraar, een spion, een schild - dit nanodeeltje draagt veel hoeden in het lichaam

- Het deksel optillen op siliconenbatterijen

- Frequentieconversie van licht op kleine schaal via gouden nanostructuur met minuscule gaten
- Inprenten van nanopatronen in metalen

- Wetenschappers vinden 3D-materiaal dat 2D-grafeen nabootst

 Soorten destillatie
Soorten destillatie  3D-printen van de volgende generatie batterijen
3D-printen van de volgende generatie batterijen Wegenzout vervuilt meer in een van de grootste beschermde gebieden van de VS, nieuwe studie toont
Wegenzout vervuilt meer in een van de grootste beschermde gebieden van de VS, nieuwe studie toont Scholen minder belangrijk dan ouders bij het bepalen van ambities voor hoger onderwijs
Scholen minder belangrijk dan ouders bij het bepalen van ambities voor hoger onderwijs Studie vindt grote besparingen bij het verwijderen van dammen boven reparaties
Studie vindt grote besparingen bij het verwijderen van dammen boven reparaties Rechter:gebruiker van sociale media heeft geen recht op anonimiteit
Rechter:gebruiker van sociale media heeft geen recht op anonimiteit Kids Science Fair-experimenten met basketbalwedstrijden
Kids Science Fair-experimenten met basketbalwedstrijden  Franse startup Plume probeert luchtkwaliteit te crowdsourcen
Franse startup Plume probeert luchtkwaliteit te crowdsourcen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

