
Wetenschap
Wat is de massa van 43,7 liter helium bij STP?
We kunnen de ideale gaswet gebruiken om de massa van helium te berekenen:
$$PV =nRT$$
waar:
- P is de druk in atm
- V is het volume in liters
- n is de hoeveelheid stof in mol
- R is de ideale gasconstante (0,08206 L * atm / mol * K)
- T is de temperatuur in Kelvin
Als we de vergelijking herschikken om n op te lossen, krijgen we:
$$n =PV/RT$$
Vervanging van de gegeven waarden:
$$n =(1 atm * 43,7 L) / (0,08206 L * atm / mol * K * 273,15 K)$$
$$n =1,923 mol$$
Ten slotte kunnen we de massa van helium berekenen door de hoeveelheid stof te vermenigvuldigen met de molaire massa:
$$massa =n * molaire massa$$
$$massa =1,923 mol * 4,0026 g/mol$$
$$massa =7,71 g$$
Daarom is de massa van 43,7 liter helium bij STP 7,71 g.
 Wat maakt moeraslichamen anders dan woestijnmummies?
Wat maakt moeraslichamen anders dan woestijnmummies?  Indonesië alert op nieuwe uitbarstingen bij afgelegen vulkaan
Indonesië alert op nieuwe uitbarstingen bij afgelegen vulkaan  Goed nieuws:habitats die bescherming verdienen in Duitsland worden beschermd
Goed nieuws:habitats die bescherming verdienen in Duitsland worden beschermd Indonesië onder deken van rook te midden van bosbranden
Indonesië onder deken van rook te midden van bosbranden Klimaatverandering zal naar verwachting de locatie van Oost-Aziatische moessons verschuiven
Klimaatverandering zal naar verwachting de locatie van Oost-Aziatische moessons verschuiven
Hoofdlijnen
- Zijn krokodillen geheime fruitliefhebbers?
- Monarchvlinders getagd met stickers in de tuin van Chicago terwijl ze naar het zuiden trekken
- Het moleculaire schild:hoe theeplanten droogte bestrijden door eiwitfosforylering
- Worden virussen als levend of niet-levend beschouwd?
- Uit welke 3 structuren bestaat het buitenoor?
- Wetenschappers ontdekken hoe vampiervleermuizen de smaak voor bloed kregen
- De zes belangrijkste dinosaurusmythen en hoe we ze hebben ontkracht
- Voorbeelden van hittebestendige bacteriën
- Hoe biologen veldwerk veiliger en rechtvaardiger maken
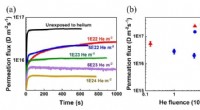
- Pre-blootstelling met helium remt de permeatie van waterstofisotopen in wandmaterialen
- SLAC's elektronenhub krijgt nieuwe metrokaart voor 's werelds krachtigste röntgenlaser
- Wetenschapper ontdekt nieuw type bi-molecuul met toepassingen voor kwantumsensoren

- 5 dingen die u niet wist over autopsies
- Metro-menigte in de spits, geregeerd door de gretigheid van mensen om naar huis te gaan

 Dodental tornado's blijven dalen, ondanks bevolkingsgroei in Tornado Alley
Dodental tornado's blijven dalen, ondanks bevolkingsgroei in Tornado Alley Er is te weinig bekend over natuurbrandrook
Er is te weinig bekend over natuurbrandrook Zoom rolt nieuwe maatregelen uit naarmate de veiligheidsrisico's toenemen
Zoom rolt nieuwe maatregelen uit naarmate de veiligheidsrisico's toenemen Uit onderzoek blijkt dat verschillende patronen leiden tot moord op huiselijke partners
Uit onderzoek blijkt dat verschillende patronen leiden tot moord op huiselijke partners  Hoe twee vloeistoffen zich aan het oppervlak vermengen:een atomair beeld
Hoe twee vloeistoffen zich aan het oppervlak vermengen:een atomair beeld  Internationale studie onthult uitzonderlijke eigenschappen van optische vezels van de volgende generatie
Internationale studie onthult uitzonderlijke eigenschappen van optische vezels van de volgende generatie Hoe het Y-Intercept te plotten als een breuk
Hoe het Y-Intercept te plotten als een breuk Hoe een perfecte storm van factoren leidde tot de moeder van alle verstoringen van de toeleveringsketen
Hoe een perfecte storm van factoren leidde tot de moeder van alle verstoringen van de toeleveringsketen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

