
Wetenschap
Hoe twee vloeistoffen zich aan het oppervlak vermengen:een atomair beeld
1. Moleculaire interacties:
Op het grensvlak van twee niet-mengbare vloeistoffen interageren de moleculen van beide vloeistoffen met elkaar. De sterkte en aard van deze moleculaire interacties bepalen de mate waarin de vloeistoffen zich zullen mengen.
- Aantrekkelijke interacties: Als er aantrekkingskrachten bestaan tussen de moleculen van de twee vloeistoffen, zoals van der Waals-krachten of waterstofbruggen, hebben deze de neiging de moleculen dichter bij elkaar te trekken, wat leidt tot gedeeltelijke menging op het grensvlak.
- Weerzinwekkende interacties: Als de moleculaire interacties overwegend afstotend zijn, zoals elektrostatische afstoting of sterische hinder, zullen de moleculen de neiging hebben elkaar weg te duwen, waardoor ze elke significante vermenging tussen de vloeistoffen weerstaan.
2. Oppervlaktespanning:
Oppervlaktespanning speelt een cruciale rol bij het mengen van vloeistoffen. Het is de energie die nodig is om het oppervlak van een vloeistof te vergroten. De oppervlaktespanning van een vloeistof wordt bepaald door de intermoleculaire krachten tussen de moleculen.
- Hoge oppervlaktespanning: Vloeistoffen met een hoge oppervlaktespanning hebben de neiging zich niet te mengen, omdat er meer energie nodig is om de oppervlaktespanningsbarrière te overwinnen en tijdens het mengen een nieuw oppervlak te creëren.
- Lage oppervlaktespanning: Vloeistoffen met een lage oppervlaktespanning mengen gemakkelijker omdat de energiebarrière voor het creëren van nieuw oppervlak relatief laag is.
3. Dichtheidsverschillen:
De dichtheid van een vloeistof is de massa per volume-eenheid. Wanneer twee niet-mengbare vloeistoffen verschillende dichtheden hebben, hebben ze de neiging zich in lagen te scheiden, waarbij de dichtere vloeistof zich op de bodem bezinkt en de minder dichte vloeistof er bovenop drijft.
- Dichtheidsgestuurd mengen: In sommige gevallen kunnen dichtheidsverschillen het mengen door convectiestromen bevorderen. Wanneer een dichte vloeistof wordt verwarmd, wordt deze minder dicht en stijgt deze, terwijl de koelere, minder dichte vloeistof zinkt. Hierdoor ontstaan circulatiepatronen die de vermenging bevorderen.
- Stabiele dichtheidslaag: Als het dichtheidsverschil tussen de vloeistoffen aanzienlijk is en er sprake is van sterke afstotende interacties, kunnen de vloeistoffen stabiele lagen vormen met minimale menging.
4. Oppervlakteactieve stoffen en emulsies:
Oppervlakteactieve stoffen zijn chemische verbindingen die de oppervlaktespanning tussen twee vloeistoffen kunnen verminderen. Wanneer ze worden toegevoegd aan een niet-mengbaar vloeibaar mengsel, kunnen oppervlakteactieve stoffen het mengen bevorderen door de energiebarrière te verminderen voor het creëren van nieuw oppervlak.
- Emulsievorming: Oppervlakteactieve stoffen kunnen ook emulsies stabiliseren, dit zijn mengsels van twee niet-mengbare vloeistoffen waarbij de ene vloeistof als kleine druppeltjes in de andere vloeistof wordt gedispergeerd. De oppervlakteactieve moleculen vormen een beschermende laag rond de druppels, waardoor ze niet kunnen samenvloeien.
Door de processen op atomair niveau te begrijpen die plaatsvinden wanneer twee niet-mengbare vloeistoffen zich vermengen, kunnen we het gedrag van vloeistofmengsels in verschillende toepassingen beter voorspellen en controleren. Deze kennis is essentieel op gebieden als chemische technologie, materiaalkunde en farmaceutische formulering, waar de nauwkeurige controle van het mengen cruciaal is voor het bereiken van de gewenste eigenschappen en prestaties.
 Om de peilstokdiagnose en omgevingstests te verbeteren, voeg gewoon tape toe
Om de peilstokdiagnose en omgevingstests te verbeteren, voeg gewoon tape toe Nieuwe inzichten in bacteriële toxines
Nieuwe inzichten in bacteriële toxines Zijn sommige dingen die we recyclen beter af op stortplaatsen?
Zijn sommige dingen die we recyclen beter af op stortplaatsen?  Bacteriën uit warmwaterbronnen lossen mysterie van metabolisme op
Bacteriën uit warmwaterbronnen lossen mysterie van metabolisme op PDGFR-kinaseremmer blijkt te beschermen tegen septische dood via regulering van BTLA
PDGFR-kinaseremmer blijkt te beschermen tegen septische dood via regulering van BTLA
 Overstromingen op zonnige dagen verhogen de fecale verontreiniging van kustwateren
Overstromingen op zonnige dagen verhogen de fecale verontreiniging van kustwateren  Wetenschappers voorspellen in de toekomst een droger Amazonegebied en natter Indonesië
Wetenschappers voorspellen in de toekomst een droger Amazonegebied en natter Indonesië NASA meet potentiële tropische cycloon 10s temperatuur
NASA meet potentiële tropische cycloon 10s temperatuur Hoe deep learning automatische clouddetectie naar nieuwe hoogten brengt
Hoe deep learning automatische clouddetectie naar nieuwe hoogten brengt Kinderen leren over klimaatverandering? Deze staat zou het nodig kunnen hebben
Kinderen leren over klimaatverandering? Deze staat zou het nodig kunnen hebben
Hoofdlijnen
- Staan we aan het begin van het einde van de westerse beschaving?
- Wereldwijd eerste genomisch onderzoek laat zien waarom invasieve soorten zo succesvol zijn
- Trias-exemplaar dat een eeuw na de ontdekking ervan vroeg verwant is aan pterosauriërs
- Grootste database over zoogdieren in Portugal nu beschikbaar
- Dieren die menselijke DNA-sequenties delen
- Actief transport: een overzicht van primair en secundair
- Wat is vergelijkende biochemie?
Vergelijkende biochemie kan een vaag begrip zijn met meerdere betekenissen, alhoewel het boeiende interacties tussen organismen en hun biologieën kan onthullen. Op zijn minst noemen wetenschappers het een interdiscip
- Hoe te differentiëren tussen mitose en cytokinese
- UW-wetenschappers ontrafelen het mysterie van hoe griepvirussen zich vermenigvuldigen
- Chaperones bereiden eiwitten gewoon voor om zelf te vouwen
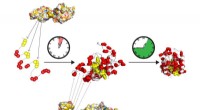
- Onderzoek naar perovskiet-silicium tandemcellen laat nieuwe weg zien

- Meervoudig mierachtig transport van neuronale lading door motoreiwitten

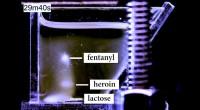
- Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren
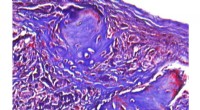
- Nieuwe hydrogels zijn veelbelovend bij de behandeling van botdefecten
 NASA-NOAA's Suomi NPP-satelliet ziet Bebinca ten oosten van het eiland Hainan
NASA-NOAA's Suomi NPP-satelliet ziet Bebinca ten oosten van het eiland Hainan Tools gebruikt om materie te meten
Tools gebruikt om materie te meten  Nieuw klimaatmodel helpt onderzoekers waterbehoefte beter te voorspellen
Nieuw klimaatmodel helpt onderzoekers waterbehoefte beter te voorspellen Onderzoekers beschrijven een nieuw apparaat voor het scannen van bundels dat gebruikmaakt van fotonische kristallen
Onderzoekers beschrijven een nieuw apparaat voor het scannen van bundels dat gebruikmaakt van fotonische kristallen Eenvoudige interesse zoeken
Eenvoudige interesse zoeken Nanotechnologie transformeert moleculaire bundels in functionele nano-apparaten met gecontroleerde atomaire architecturen
Nanotechnologie transformeert moleculaire bundels in functionele nano-apparaten met gecontroleerde atomaire architecturen Wetenschapper heeft enkele van de oudste sterren met ongekende precisie gedateerd
Wetenschapper heeft enkele van de oudste sterren met ongekende precisie gedateerd Verbetering van de productie van waterstofperoxide door duurzame fotokatalyse
Verbetering van de productie van waterstofperoxide door duurzame fotokatalyse
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

