
Wetenschap
Een nieuwe watersplitsingstechniek om schone waterstof te genereren

Foto van de onderzoekers, met (van links naar rechts):Dr. Hen Dotan, Avigail Landman, Prof. Avner Rothschild, Prof. Gideon Grader. Krediet:Chen Galili, Technion Woordvoerder Afdeling.
Bij de productie van elektrolytische waterstof wordt waterstof opgewekt uit water met behulp van elektrische energie, die idealiter afkomstig moeten zijn van hernieuwbare energiebronnen zoals zonlicht en wind. Hoewel deze methode om waterstof te produceren een veelbelovende oplossing kan zijn voor het vergroten van de duurzaamheid, maar onderzoekers zullen een aantal belangrijke uitdagingen moeten overwinnen om het wijdverbreid te laten worden.
In een recente studie in Natuur Energie , een team van onderzoekers van het Technion-Israel Institute of Technology heeft een aantal van deze uitdagingen aangepakt, de presentatie van een nieuwe techniek voor het splitsen van water die de bestaande methoden voor de productie van elektrolytische waterstof zou kunnen verbeteren. Hun onderzoek is geïnspireerd op een van hun eerdere studies over foto-elektrochemische (PEC) watersplitsing, waarin ze probeerden zonne-energie en water (foto)elektrolyse te combineren om waterstof te maken uit zonlicht en water.
Een van de grootste uitdagingen die in dit eerdere werk werden geschetst, was het verzamelen van waterstofgas uit miljoenen PEC-cellen die in het zonneveld zijn verspreid. In hun studie hebben de op Technion gebaseerde onderzoekers probeerden een techniek te ontwikkelen die deze uitdaging effectief kon aanpakken.
"Met fotovoltaïsche (PV) zonne-installaties als basisscenario, het zonnepark bestaat uit miljoenen individuele PV-cellen, waar de stroom (en spanning) van elk van hen wordt verzameld in een metalen rooster, "Avner Rothschild, een van de onderzoekers die het onderzoek heeft uitgevoerd, vertelde TechXplore. "Dit is gemakkelijk met elektriciteit, maar niet zo met waterstofgas."
In een ideale PEC-zonnecentrale van de toekomst, PV-cellen zouden worden vervangen door PEC-cellen, die waterstof kan produceren in een component die bekend staat als het kathodecompartiment, en zuurstof in een aparte kamer, een anodecompartiment genaamd. Deze twee compartimenten moeten worden gescheiden, op zijn minst door een membraan, om ervoor te zorgen dat waterstof en zuurstof niet vermengen, omdat dit een explosie zou veroorzaken. In aanvulling, het waterstofgas moet uit elke afzonderlijke cel worden opgevangen.
Het maken van deze opstelling is tot nu toe technisch moeilijk en duur gebleken, omdat het een zeer kostbaar leidingverdeelstuk vereist. uiteindelijk, dit maakt het realiseren van oplossingen voor grootschalige waterstofproductie door PEC-watersplitsing onrealistisch.
"We zochten een uitweg uit deze uitdaging, en kwam op het idee om de zuurstof- en waterstofcompartimenten in de PEC-cel te scheiden in twee afzonderlijke cellen, zodat de zuurstof wordt gegenereerd in het zonneveld en wordt afgegeven aan de atmosfeer, overwegende dat de waterstof wordt gegenereerd in een centrale reactor op de hoek van het veld, Rothschild zei. "De scheiding in twee cellen wordt mogelijk gemaakt door een andere set van twee elektroden in te brengen, hulpelektroden genoemd, die gelijktijdig worden opgeladen en ontladen door OH - ionen die betrokken zijn bij de watersplitsingsreactie, waardoor de ionenuitwisseling tussen de twee cellen wordt bemiddeld (wat nodig is om het elektrische circuit te sluiten)."
In hun vorige krant gepubliceerd in Natuurmaterialen , Rothschild en zijn collega's presenteerden een disruptieve nieuwe benadering voor waterelektrolyse (elektrolyzers) en foto-elektrolyse (PEC) architecturen. Deze veelbelovende aanpak, echter, introduceerde een andere uitdaging om de hulpelektroden te regenereren wanneer ze verzadigd raken aan het einde van een productiecyclus. De onderzoekers suggereerden dat de elektroden aan het einde van elke cyclus konden worden verwisseld, maar dit zou nogal omslachtig zijn, dus bleven ze alternatieve oplossingen onderzoeken.
"Toen ontdekten we dat als je de hulpelektrode in de waterstofcel verwarmt, nadat het was opgeladen (om NiOOH te worden), het laat spontaan zuurstofgasbellen vrij en regenereert naar zijn oorspronkelijke staat (Ni(OH) 2 ), " zei Rothschild. "Deze ontdekking leidde tot de ontwikkeling van het E-TAC-watersplitsingsproces dat in het huidige werk wordt gepresenteerd."
E-TAC, de nieuwe watersplitsingstechniek voorgesteld door Rothschild en zijn collega's, heeft een hoge energie-efficiëntie van 98,7 procent, daarom presteert het aanzienlijk beter dan conventionele elektrolysers, die doorgaans een energie-efficiëntie hebben van ~70 tot 80 procent voor ultramoderne apparaten. Een ander voordeel van E-TAC is dat het achtereenvolgens waterstof en zuurstof produceert, terwijl in de meeste andere elektrolysers, ze worden gelijktijdig geproduceerd. Dit elimineert uiteindelijk de noodzaak van een membraan dat de waterstof- en zuurstofgassen scheidt, waardoor de constructie en montage van de cellen aanzienlijk wordt vereenvoudigd, evenals hun werking en onderhoud.
"Mogelijk, dit zou zich kunnen vertalen in grote besparingen op kapitaal- en bedrijfskosten, leidend tot de ontwikkeling van kosteneffectieve watersplitsingstechnologie die kan concurreren met SMR (stoommethaanreforming), goedkope waterstof aanbieden zonder CO 2 uitstoot, op voorwaarde dat de elektriciteit afkomstig is uit hernieuwbare bronnen zoals waterkracht, zonne- of windenergie, ' zei Rothschild.
Bij conventionele waterelektrolyse, waterstof en zuurstof worden altijd gelijktijdig geproduceerd in de kathode- en anodecompartimenten, respectievelijk. De compartimenten zijn zo dicht mogelijk bij elkaar geplaatst, om elektrische Ohmse verliezen te minimaliseren, en ze zijn gescheiden door een membraan om de vorming van een explosief H . te voorkomen 2 /O 2 mengsel.
"De kathode reduceert water, waterstof genereren (H 2 moleculen) en hydroxide-ionen (OH - ) door een reactie die bekend staat als HER (hydrogen evolution reaction), " zei Rothschild. "De OH - ionen migreren naar de anode door de elektrolyt en door het membraan, waar ze worden geoxideerd door de OER (zuurstofevolutiereactie). Samen, deze twee reacties (HER en OER) voltooien de watersplitsingsreactie:2H 2 O 2H 2 + O 2 ."
Bij conventionele waterelektrolyse, de twee elektrochemische reacties beschreven door Rothschild zijn gekoppeld in zowel tijd als ruimte, als ze tegelijkertijd voorkomen, in dezelfde cel en dicht bij elkaar. Bovendien, deze kenmerken zijn hetzelfde, ongeacht of het proces wordt toegepast op alkalische of PEM-elektrolyzers.
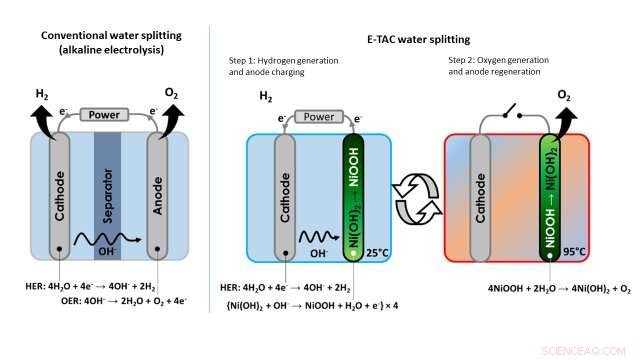
Afbeelding die het verschil laat zien tussen de conventionele benadering van watersplitsing (alkalische elektrolyse) en de door de onderzoekers voorgestelde E-TAC watersplitsingstechniek. Krediet:Dotan et al.
In tegenstelling tot deze traditionele benadering van waterelektrolyse, het door de onderzoekers bedachte watersplitsingsproces ontkoppelt de HER- en OER-reacties, die in plaats daarvan op verschillende tijdstippen en mogelijk in verschillende delen van een apparaat plaatsvinden. In plaats van continu te zijn, daarom, E-TAC kan worden omschreven als een 'batchproces' met twee cycli, de eerste genereert elektrochemisch waterstof en de tweede zuurstof via een spontane chemische reactie.
"We plaatsen de kathode (dezelfde kathode die wordt gebruikt bij alkalische elektrolyse) en de anode (die anders is dan de anode bij conventionele elektrolyse) in een elektrolytische cel en laten er stroom tussen, Rothschild zei. "De kathode genereert waterstof door de HER-reactie, net als bij de conventionele waterelektrolyse, maar de anode doet iets heel anders. De anode wordt in wezen opgeladen door de OH . te absorberen - ionen die worden gegenereerd aan de kathode, en geleidelijk transformeren van Ni (OH) 2 (nikkelhydroxide) naar NiOOH (nikkel-oxyhydroxide)."
interessant, de reactie die in de anode wordt geproduceerd, is dezelfde die optreedt bij de kathode van alkalinebatterijen (bijv. Ni-MH-batterijen) terwijl ze worden opgeladen. Dit suggereert dat het voor veel cycli goed kan werken, net als bij alkalinebatterijen.
Soms, echter, het opladen van de anode in het E-TAC-proces moet worden onderbroken, want als het teveel wordt aangerekend, het zou kunnen beginnen met het genereren van zuurstof. Wanneer de lading boven een bepaald niveau komt, daarom, de onderzoekers moeten de spanning die op de cellen wordt toegepast, beperken om mogelijke explosies door de co-generatie van zuurstof en waterstof te voorkomen.
"Om het E-TAC-proces voort te zetten, we moeten dan de geladen anode (NiOOH) terug regenereren naar zijn oorspronkelijke staat (Ni(OH) 2 ), " Rothschild explained. "We do so by raising its temperature, thereby accelerating the rate of the spontaneous chemical reaction between the charged anode and water, which releases oxygen and regenerates the anode back to its initial state."
The technique devised by Rothschild and his colleagues thus entails the use of heat to control the chemical reaction that generates oxygen, as the rate of the reaction slows down at low temperatures and accelerates at high temperatures. The generation of hydrogen occurs at a low or ambient temperature, and the generation of oxygen at high temperatures around 95 degrees Celsius. This is why the researchers decided to call it the E-TAC process, which stands for electrochemical-thermally activated chemical process.
"In the proof-of-concept lab tests presented in our article, we manually moved the anode from the cold cell (i.e. a glass beaker filled with alkaline aqueous solution at ambient temperature) to the hot cell (i.e. the same type of beaker, but heated to 95 degrees Celsius), so the separation between hydrogen and oxygen generation was not only in time but also in place, " Rothschild explained. "However, in a real-world industrial system, we foresee a different scenario in which the two electrodes (anode and cathode) and stationary (not moving), whereas the cell in which they are is filled sequentially with cold or hot electrolyte solutions."
Separating the production of hydrogen and oxygen, which removes the need for a membrane separating the two different chambers inside electrolytic cells, results in substantial savings over traditional electrolysis approaches. In feite, sealing the membrane is generally expensive and also complicates the overall production process. The membrane in conventional systems requires high-purity water and ongoing maintenance, all of which are unnecessary in E-TAC.
In aanvulling, the technique devised by Rothschild and his colleagues entirely eliminates the risk of volatile encounters between oxygen and hydrogen, as well as resulting explosions. In traditional systems, anderzijds, this risk is still present, as the membrane could rip or its seal could break.
"Momenteel, the use of membranes also limits the pressure in hydrogen production, " Rothschild said. "E-TAC renders the membrane unnecessary, thus facilitating hydrogen production under much higher pressure and eliminating some of the high costs of compressing the hydrogen later. Bovendien, in the new process we proposed, oxygen is produced via a spontaneous chemical reaction between the charged anode and the water, without using an electrical current. This reaction eliminates the need for electricity during oxygen production and increases energetic efficiency from ~70 to 80 percent using customary methods to an unprecedented 98.7 percent."
The technique developed by Rothschild and his colleagues could lower operating costs of sustainable hydrogen production and equipment costs. The researchers have estimated that the production costs for equipment based on E-TAC would be approximately half of those for existing technologies.
"The process we invented presents a conceptual breakthrough in water splitting, and in view of the advantages it offers, it may become a game-changer and lead to a new technology for hydrogen production from water without CO 2 emissions, which could compete with SMR to produce clean hydrogen and enable the transition from fossil fuels to clean hydrogen fuel, " Rothschild said.
After they finished writing their paper, the researchers at Technion patented their invention and founded a start-up called H 2 Pro, with the mission of developing and distributing new water splitting technology based on the E-TAC technique. They hope to soon commercialize this technology by scaling-up the electrodes and cells used in their study, constructing and testing hydrogen generators based on the E-TAC water-splitting process, optimizing their operation scheme and examining high-pressure hydrogen production.
"We also plan to carry out further academic research to study new electrode materials and apply advanced analytical methods to understand the correlations between electrode composition and microstructure and its function properties, in order to develop the next generation of Ni(OH) 2 -based electrodes for our E-TAC water-splitting process, " Rothschild said. "Our goal is to improve their capacity (so that we can run longer processes) with fast charging and regeneration rates to enable high hydrogen production rates."
© 2019 Wetenschap X Netwerk
 Met moleculaire gegevensopslag, kattenvideo's kunnen ons allemaal overleven
Met moleculaire gegevensopslag, kattenvideo's kunnen ons allemaal overleven Het algemeen gebruik voor wijnsteenzuur
Het algemeen gebruik voor wijnsteenzuur  Een glas water met rode kleurstof terugdraaien in helder water
Een glas water met rode kleurstof terugdraaien in helder water Onderzoekers vinden een betere manier om metaallegeringen te ontwerpen
Onderzoekers vinden een betere manier om metaallegeringen te ontwerpen Wetenschappers bakken glutenvrij brood met een revolutionaire technologie
Wetenschappers bakken glutenvrij brood met een revolutionaire technologie
 Hier is wat Youd echt ziet als je de Noordpool bezoekt
Hier is wat Youd echt ziet als je de Noordpool bezoekt Kan een aardbeving in Colorado zijn veroorzaakt door de impact van het uitsterven van dinosauriërs?
Kan een aardbeving in Colorado zijn veroorzaakt door de impact van het uitsterven van dinosauriërs? Onderzoekers documenteren wijdverbreid methaan dat voor de kust van Oregon sijpelt
Onderzoekers documenteren wijdverbreid methaan dat voor de kust van Oregon sijpelt Voedselscanner in zakformaat
Voedselscanner in zakformaat Stedelijk land en aerosols versterken gevaarlijk weer, stuur stormen richting steden
Stedelijk land en aerosols versterken gevaarlijk weer, stuur stormen richting steden
Hoofdlijnen
- Kenmerken van micro-organismen
- Planten evolueren geuren en kleuren om dieren aan te trekken voor zaadverspreiding
- Een boom die zichzelf bezit, groeit in Athene,
- Daar is een studie over:het stenen tijdperk had net zoveel linkse mensen
- Lichaamsdelen en functies
- Waarom sommige mensen flauwvallen als ze bloed zien
- Op bewijs gebaseerde tips om uw geheugen te verbeteren
- Wat is zelfrespect?
- Los Angeles Zoos oude Indiase neushoorn geëuthanaseerd
- Legers nieuwe 3D-geprinte vormveranderende zachte robots kruipen, springen, grijpen

- Google prijst vooruitgang in strijd tegen piraterij

- Onder vuur techsector komt samen in Portugal

- Opstart-push-softwaresysteem voor het veranderen van gezondheidsgedrag

- Drone-waarneming stopt vluchten op Dublin Airport in Ierland

 Wat is de vergelijking voor het vinden van de begintemperatuur?
Wat is de vergelijking voor het vinden van de begintemperatuur?  Bodemleven gedijt tussen oliepalmbladeren
Bodemleven gedijt tussen oliepalmbladeren Hoe hedendaagse MBA-afgestudeerden kunnen helpen de wereld te redden
Hoe hedendaagse MBA-afgestudeerden kunnen helpen de wereld te redden De drie soorten watervervuiling
De drie soorten watervervuiling  Hexamere lanthanide-organische capsules met tertiaire structuur, opkomende functies
Hexamere lanthanide-organische capsules met tertiaire structuur, opkomende functies Containers maken voor een Egg Drop Experiment
Containers maken voor een Egg Drop Experiment Taskforce:veranderingen nodig om Afro-Amerikaanse natuurkunde- en sterrenkundestudenten te vergroten
Taskforce:veranderingen nodig om Afro-Amerikaanse natuurkunde- en sterrenkundestudenten te vergroten Gedragsbomen gebruiken om de modulariteit van AUV-regelsystemen te verbeteren
Gedragsbomen gebruiken om de modulariteit van AUV-regelsystemen te verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

