
Wetenschap
Waarom reageren verschillende metalen anders met zuur?
1. Positie in de reactiviteitsreeks:
* Elektrochemische serie: Metalen zijn gerangschikt in de elektrochemische serie op basis van hun neiging om elektronen te verliezen (oxideren). Metalen hoger in de serie zijn reactiever, wat betekent dat ze elektronen gemakkelijker verliezen.
* reactiviteit met zuren: Metalen boven waterstof in de reactiviteitsreeks reageren met zuren om waterstofgas en een zout te produceren. Metalen onder waterstof in de serie reageren niet met zuren.
Voorbeeld:
* Natrium (NA) is reactiever dan waterstof (H): Het reageert krachtig met zuren zoals zoutzuur (HCL) om waterstofgas en natriumchloride (NaCl) te produceren.
* Koper (Cu) is minder reactief dan waterstof: Het reageert niet met verdunde zuren zoals HCl of zwavelzuur (h₂so₄).
2. Standaardreductiepotentieel:
* Elektronenaffiniteit: Het standaardreductiepotentiaal (E °) van een metaal weerspiegelt de neiging om elektronen te winnen. Metalen met meer negatieve E ° -waarden verliezen eerder elektronen en reageren met zuren.
* Oxidatiepotentieel: Metalen met positief oxidatiepotentieel zijn meer reactief met zuren.
Voorbeeld:
* zink (Zn) heeft een meer negatieve E ° dan koper (Cu): Dit betekent dat zink eerder elektronen verliest en reageert met zuren.
3. Aard van het zuur:
* Sterkte van het zuur: Sterkere zuren (zoals zoutzuur) reageren eerder met metalen dan zwakkere zuren (zoals azijnzuur).
* concentratie van het zuur: Geconcentreerde zuren zijn over het algemeen reactiever dan verdunde zuren.
* Aanwezigheid van oxiderende middelen: Sommige zuren (zoals salpeterzuur) bevatten oxidatiemiddelen die met metalen kunnen reageren, zelfs als ze minder reactief zijn dan waterstof.
4. Oppervlakte van het metaal:
* Verhoogd oppervlak: Een groter oppervlak zorgt voor meer contact met het zuur, waardoor de reactiesnelheid wordt verhoogd.
Voorbeeld:
* Een metaal in poedervorm zal sneller reageren met een zuur dan een massief stuk van hetzelfde metaal.
Samenvattend:
De reactiviteit van metalen met zuren is een complex samenspel van factoren, waaronder hun positie in de reactiviteitsreeks, standaardreductiepotentieel, aard van het zuur en het oppervlak. Het begrijpen van deze factoren helpt de uitkomst van metaalzuurreacties te voorspellen.
 Voorspellers:Droogte deze winter waarschijnlijker dan sneeuwstormen
Voorspellers:Droogte deze winter waarschijnlijker dan sneeuwstormen Onderzoeksproject over de Atlantische Oceaan benadrukt de wereldwijde inspanningen om de mariene biodiversiteit te behouden
Onderzoeksproject over de Atlantische Oceaan benadrukt de wereldwijde inspanningen om de mariene biodiversiteit te behouden  Identificatie van ratelslangen
Identificatie van ratelslangen Het aanwakkeren van een conflict tussen landbouw en natuurbehoud doet iedereen pijn
Het aanwakkeren van een conflict tussen landbouw en natuurbehoud doet iedereen pijn Waarom is het verval belangrijk in een ecosysteem?
Waarom is het verval belangrijk in een ecosysteem?
Hoofdlijnen
- Zullen geavanceerde organismen hetzelfde zijn als complexe organismen, waarom?
- Wat zijn de drie componenten van een DNA-molecuul?
- Een organel gevonden in de celkern is een?
- Hoe komen virussen in cellen? Hun infectietactieken bepalen of ze over soorten heen kunnen springen of een pandemie kunnen veroorzaken
- Licht schijnen op het sociale leven van virussen
- In welke klasse hoort Fern mee?
- Welke indicatoren worden gebruikt voor elk molecuul eenvoudige suikers zetmeel lipiden eiwitten?
- Wat is de functie van begeleidende cellen?
- Luipaard gevangen na 36 uur op jacht naar fabriek in India
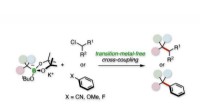
- Nieuwe procedure zal de behoefte aan zeldzame metalen in chemische synthese verminderen
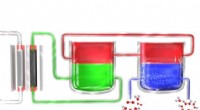
- Nieuw proces kan waterstofperoxide beschikbaar maken op afgelegen plaatsen
- Recycling van plastic:vinylpolymeer afgebroken tot aspirinecomponenten

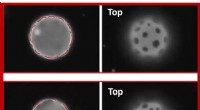
- Onderzoeksteam ontdekt gebruik van elasticiteit om microplaten op gebogen 2D-vloeistoffen te positioneren
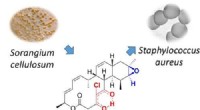
- Antimicrobieel natuurlijk product actief tegen zowel MRSA als malaria veroorzakende parasiet
 Maakt THC een deel van mijn chemische make -up?
Maakt THC een deel van mijn chemische make -up?  Historici laten zien hoe engelen de puriteinse zuivering overleefden door rond sterfbedden te hangen
Historici laten zien hoe engelen de puriteinse zuivering overleefden door rond sterfbedden te hangen  Natuurlijke blauwe voedselkleuring krijgt een milieuvriendelijke productieboost
Natuurlijke blauwe voedselkleuring krijgt een milieuvriendelijke productieboost Wat gebeurt er met de energie als een materiaal verdampt of smelt?
Wat gebeurt er met de energie als een materiaal verdampt of smelt?  Is gearomatiseerd drankje een homogeen mengsel?
Is gearomatiseerd drankje een homogeen mengsel?  Wat zijn twee krachten die een snelheid kunnen beïnvloeden?
Wat zijn twee krachten die een snelheid kunnen beïnvloeden?  Alarmerende projecties voor poolijskappen
Alarmerende projecties voor poolijskappen Hoe bacteriën omgaan met stress
Hoe bacteriën omgaan met stress
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

