
Wetenschap
Wat gebeurt er als natrium wordt behandeld met ammoniak?
1. Vorming van natrium-ammoniakcomplex :Wanneer natrium in contact komt met watervrije ammoniak, vormt het aanvankelijk een natrium-ammoniakcomplex. Dit complex omvat de solvatatie van natriumionen (Na+) door ammoniakmoleculen (NH3). De ammoniakmoleculen omringen de natriumionen, waardoor een gesolvateerde soort ontstaat die verder kan reageren.
2. Elektronenoverdracht en waterstofevolutie :De reactie tussen natrium en ammoniak is een redoxreactie, waarbij natrium werkt als reductiemiddel en ammoniak als oxidatiemiddel. Tijdens de reactie dragen de zeer elektropositieve natriumatomen elektronen over aan ammoniakmoleculen. Deze overdracht leidt tot de reductie van ammoniak, resulterend in de vorming van waterstofgas (H2) en amide-ionen (NH2-).
De totale reactie kan als volgt worden weergegeven:
2Na + 2NH3 → 2NaNH2 + H2
3. Natriumamidevorming :De bij de reactie gevormde amide-ionen (NH2-) combineren met natriumionen (Na+) om natriumamide (NaNH2) te produceren. Natriumamide is een kleurloze, kristallijne verbinding die oplosbaar is in ammoniak en bepaalde organische oplosmiddelen. Het is een veelzijdig reagens dat veel wordt gebruikt in organische synthese en industriële processen.
4. Evolutie van waterstofgas :Als bijproduct van de reactie ontstaat waterstofgas (H2). Het geproduceerde waterstofgas kan worden opgevangen en gebruikt in verschillende toepassingen, zoals brandstofcellen, hydrogeneringsprocessen en als reductiemiddel bij bepaalde chemische reacties.
Het is belangrijk op te merken dat deze reactie onder gecontroleerde omstandigheden moet worden uitgevoerd, meestal in een laboratoriumomgeving, met gebruikmaking van passende veiligheidsmaatregelen en hanteringstechnieken. Natrium kan krachtig reageren met water, dus het gebruik van watervrije ammoniak is van cruciaal belang om ongewenste reacties of gevaren te voorkomen.
 Oprolbare tv's en buigbare smartphones:de toekomst van flexibele elektronische materialen
Oprolbare tv's en buigbare smartphones:de toekomst van flexibele elektronische materialen Welke elementen zijn gevonden Clorox-doekjes?
Welke elementen zijn gevonden Clorox-doekjes?  Nieuw isolatiemateriaal zorgt voor een efficiëntere elektriciteitsdistributie
Nieuw isolatiemateriaal zorgt voor een efficiëntere elektriciteitsdistributie Deze kleine, zelfassemblerende vallen vangen PFAS
Deze kleine, zelfassemblerende vallen vangen PFAS Is het mengen van jodium en zuiveringszout een chemische of fysieke verandering?
Is het mengen van jodium en zuiveringszout een chemische of fysieke verandering?
 Waarom Irma zo sterk is en andere vragen over orkanen
Waarom Irma zo sterk is en andere vragen over orkanen Extreme weersvoorspellingen:algoritme brengt bestaande klimaatsimulaties dichter bij de toekomstige realiteit
Extreme weersvoorspellingen:algoritme brengt bestaande klimaatsimulaties dichter bij de toekomstige realiteit  Nieuw onderzoek identificeert patronen van boomdistributie in Afrikaanse savannes
Nieuw onderzoek identificeert patronen van boomdistributie in Afrikaanse savannes Groot-Brittannië intensiveert strijd tegen klimaatverandering
Groot-Brittannië intensiveert strijd tegen klimaatverandering Atmosferische kooldioxide veroorzaakt wereldwijde vergroening waardoor sommige gebieden warmer en sommige kouder worden
Atmosferische kooldioxide veroorzaakt wereldwijde vergroening waardoor sommige gebieden warmer en sommige kouder worden
Hoofdlijnen
- Bloei en mislukking:nieuw onderzoek laat precies zien hoe verschrikkelijk algen zijn voor de economie van Florida
- Hoe maak je een dierencel uit Candy
- Nieuwe vlindersoort ontdekt in Rusland met een ongewone set van 46 chromosomen
- Mening:Australië bevindt zich in een unieke positie om de bijendodende Varroamijt uit te roeien. Dit is wat er gebeurt als we dat niet doen
- Wat is histonacetylatie?
- Schildpadkracht:hoe samen uitbroeden gevangenneming voorkomt
- Onderzoekers richten zich op invasieve, verderfelijke gevlekte lantaarnvlieg
- Studie werpt licht op hoe scramblase-eiwitten celmembranen herschikken
- Hoe je hersenen werken
- Peptide-vingerafdruk maakt eerdere diagnose van de ziekte van Alzheimer mogelijk

- Chemicus ontwikkelt synthesemethode voor 28 biologisch actieve moleculen
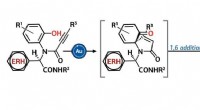
- Enzymconformatie beïnvloedt de prestaties van lipase-aangedreven nanomotoren
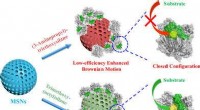
- Ga de piste op met biobased ski's en snowboards

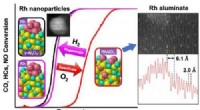
- Toekomstige katalysatoren kunnen meer waar voor je geld geven
 Hebben Aziatische citruspsylliden hoogtevrees? Nieuw onderzoek kan aanwijzingen geven om ze te stoppen
Hebben Aziatische citruspsylliden hoogtevrees? Nieuw onderzoek kan aanwijzingen geven om ze te stoppen  'Tijd om te eten':Video's laten zien dat het tikken van de tenen door kikkers een strategie kan zijn om prooien uit te lokken
'Tijd om te eten':Video's laten zien dat het tikken van de tenen door kikkers een strategie kan zijn om prooien uit te lokken  Het tappen van zoet water onder de oceaan heeft gevolgen
Het tappen van zoet water onder de oceaan heeft gevolgen AI gebruiken om satellietbeelden te verbeteren om de planeet te monitoren
AI gebruiken om satellietbeelden te verbeteren om de planeet te monitoren  Hoe exclusieve 'laser shock peening'-technologie de betrouwbaarheid en levensduur van vliegtuigen verbetert
Hoe exclusieve 'laser shock peening'-technologie de betrouwbaarheid en levensduur van vliegtuigen verbetert  Eerste grootschalige doxing-studie onthult motivaties en doelen voor cyberpesten
Eerste grootschalige doxing-studie onthult motivaties en doelen voor cyberpesten Op welke 4 manieren kan energie worden overgedragen?
Op welke 4 manieren kan energie worden overgedragen?  Giftige chemicaliën bellen:mobiele telefoons als bron van vlamvertragers
Giftige chemicaliën bellen:mobiele telefoons als bron van vlamvertragers
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

