
Wetenschap
Nieuw proces kan waterstofperoxide beschikbaar maken op afgelegen plaatsen
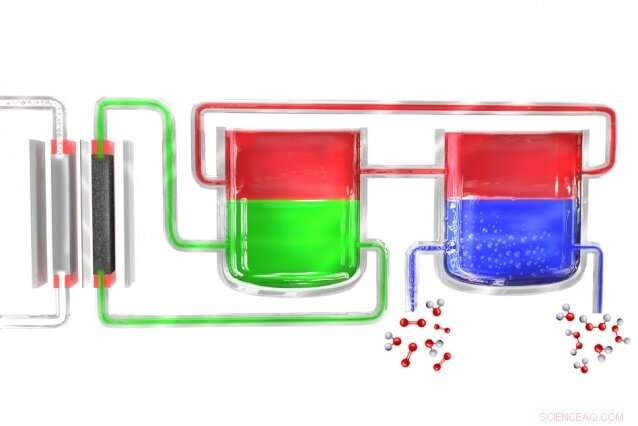
In een nieuwe methode om waterstofperoxide draagbaar te produceren, een elektrolyseur (links) splitst water in waterstof en zuurstof. De waterstofatomen vormen zich aanvankelijk in een elektrolytmateriaal (groen), die ze overbrengt naar een bemiddelaarmateriaal (rood), die ze vervolgens naar een aparte eenheid voert waar de mediator in contact komt met zuurstofrijk water (blauw), waar de waterstof zich ermee verbindt om waterstofperoxide te vormen. De bemiddelaar keert dan terug om de cyclus opnieuw te beginnen. Krediet:Massachusetts Institute of Technology
Waterstof peroxide, een nuttig ontsmettingsmiddel voor alle doeleinden, is te vinden in de meeste medicijnkasten in de ontwikkelde wereld. Maar in afgelegen dorpen in ontwikkelingslanden, waar het een belangrijke rol zou kunnen spelen op het gebied van gezondheid en sanitaire voorzieningen, het kan moeilijk zijn om langs te komen.
Nutsvoorzieningen, een proces ontwikkeld aan het MIT zou kunnen leiden tot een eenvoudige, goedkoop, draagbaar apparaat dat continu waterstofperoxide kan produceren uit alleen lucht, water, en elektriciteit, een manier bieden om wonden te steriliseren, voedselbereidingsoppervlakken, en zelfs watervoorraden.
De nieuwe methode wordt deze week beschreven in het journaal Joule in een paper van MIT-studenten Alexander Murray, Sahag Voskian, en Marcel Schreier en MIT-professoren T. Alan Hatton en Yogesh Surendranath.
Zelfs bij lage concentraties, waterstofperoxide is een effectief antibacterieel middel, en na het uitvoeren van zijn steriliserende functie valt het uiteen in gewoon water, in tegenstelling tot andere middelen zoals chloor die ongewenste bijproducten van de productie en het gebruik kunnen achterlaten.
Waterstofperoxide is gewoon water met een extra zuurstofatoom eraan vastgemaakt - het is H2O2, in plaats van H2O. Die extra zuurstof is relatief losjes gebonden, waardoor het een zeer reactieve chemische stof is die graag andere moleculen eromheen wil oxideren. Het is zo reactief dat het in hoge concentraties kan worden gebruikt als raketbrandstof, en zelfs concentraties van 35 procent vereisen zeer speciale behandelings- en verzendingsprocedures. Het soort dat als huishoudelijk ontsmettingsmiddel wordt gebruikt, is meestal slechts 3 procent waterstofperoxide en 97 procent water.
Omdat hoge concentraties moeilijk te transporteren zijn, en lage concentraties, meestal water zijn, zijn oneconomisch om te verzenden, het materiaal is vaak moeilijk te krijgen op plaatsen waar het bijzonder nuttig zou kunnen zijn, zoals afgelegen gemeenschappen met onbehandeld water. (Bacteriën in watervoorraden kunnen effectief worden bestreden door waterstofperoxide toe te voegen.) veel onderzoeksgroepen over de hele wereld hebben benaderingen nagestreefd om een of andere vorm van draagbare waterstofperoxideproductieapparatuur te ontwikkelen.
Het grootste deel van het waterstofperoxide dat in de geïndustrialiseerde wereld wordt geproduceerd, wordt gemaakt in grote chemische fabrieken, waar methaan, of aardgas, wordt gebruikt als bron van waterstof, die vervolgens wordt omgezet met zuurstof in een katalytisch proces onder hoge hitte. Dit proces is energie-intensief en niet gemakkelijk schaalbaar, waarvoor grote apparatuur en een constante aanvoer van methaan nodig zijn, dus het leent zich niet voor kleinere eenheden of afgelegen locaties.
"Er is een groeiende gemeenschap geïnteresseerd in draagbare waterstofperoxide, "Surendranath zegt, "vanwege de waardering dat het echt in veel behoeften zou voorzien, zowel aan de industriële kant als op het gebied van menselijke gezondheid en sanitaire voorzieningen."
Andere processen die tot nu toe zijn ontwikkeld voor mogelijk draagbare systemen hebben belangrijke beperkingen. Bijvoorbeeld, de meeste katalysatoren die de vorming van waterstofperoxide uit waterstof en zuurstof bevorderen, maken ook veel water, wat leidt tot lage concentraties van het gewenste product. Ook, processen waarbij elektrolyse betrokken is, zoals dit nieuwe proces doet, hebben vaak moeite om het geproduceerde waterstofperoxide te scheiden van het elektrolytmateriaal dat in het proces wordt gebruikt, weer leidt tot een laag rendement.
Surendranath en de rest van het team hebben het probleem opgelost door het proces op te splitsen in twee afzonderlijke stappen. Eerst, elektriciteit (idealiter van zonnecellen of windmolens) wordt gebruikt om water af te breken in waterstof en zuurstof, en de waterstof reageert dan met een "drager"-molecuul. Dit molecuul, een verbinding genaamd anthroquinon, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. In het proces, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath says, by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, hij voegt toe, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Dus, bijvoorbeeld, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " hij zegt.
"It's kind of an amazing process, " hij zegt, "because you take abundant things, water, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, zout, baseren, enzovoort., all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, die niet bij dit werk betrokken was. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Veelbelovend nieuw pad op zonne-energie voor de productie van waterstofbrandstof
Veelbelovend nieuw pad op zonne-energie voor de productie van waterstofbrandstof Drie kenmerken van de perfecte vlam op een bunsenbrander
Drie kenmerken van de perfecte vlam op een bunsenbrander  Vijf manieren om chemische reacties te zien
Vijf manieren om chemische reacties te zien
Een chemische reactie treedt op wanneer twee of meer materialen een wisselwerking hebben en transformeren in nieuwe stoffen. Bijvoorbeeld, wanneer water wordt gemengd met zuiveringszout, produceren de mol
 De lengte van supramoleculaire polymeren regelen
De lengte van supramoleculaire polymeren regelen Nobelprijswinnende techniek zoals Google Earth voor moleculen
Nobelprijswinnende techniek zoals Google Earth voor moleculen
Hoofdlijnen
- Van Alaska tot Amazonia:de eerste wereldwijde kaarten met eigenschappen die de groei van vegetatie stimuleren
- Dode bomen leven met schimmels
- Wat zijn concentratiegradiënten in de microbiologie?
- Onderzoekers verwachten dat nieuwe vispassage de trekvispopulaties zal herstellen
- Langoustines hongeren naar kwallen gevangen op camera
- Ontdekking van een mechanisme om de richting van collectieve celmigratie te bepalen
- Een konijn ontleden
- Belang van vrije ribosomen
- Zalmen helpen hun nakomelingen door te sterven op de paaigronden
- Wetenschappers onthullen dubbele levensduur van zonnebloemenzym

- Displays maken met rijkere kleuren
- Hoe goed is een wedstrijd? Statistieken in forensische vuurwapenidentificatie zetten

- Mobiliteit op waterstof komt dichterbij met brandstofcelsystemen van de volgende generatie
- Waterdruppels als geminiaturiseerde reageerbuisjes

 Zelfherstellende folie op gelatinebasis kan een slimme zet zijn voor elektronica
Zelfherstellende folie op gelatinebasis kan een slimme zet zijn voor elektronica Jodium boegschroef kan de ophoping van ruimteafval vertragen
Jodium boegschroef kan de ophoping van ruimteafval vertragen Waterstofmobiliteit uit hernieuwbare energie
Waterstofmobiliteit uit hernieuwbare energie Geschikte energiemix voor kleinere gemeenschappen
Geschikte energiemix voor kleinere gemeenschappen Een goedkope, hoogwaardige multinaire intermetallische verbinding als actieve elektrokatalysator voor waterstofproductie
Een goedkope, hoogwaardige multinaire intermetallische verbinding als actieve elektrokatalysator voor waterstofproductie Zirkonium gebruiken als additief in supersterke composietmaterialen
Zirkonium gebruiken als additief in supersterke composietmaterialen Tweaktools om tweets in de loop van de tijd bij te houden
Tweaktools om tweets in de loop van de tijd bij te houden Studie kijkt naar humor op sociale media tijdens Amerikaanse verkiezingen
Studie kijkt naar humor op sociale media tijdens Amerikaanse verkiezingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

