
Wetenschap
Wat is de millimolaire oplosbaarheid van zuurstofgas O2 in water bij 20 ° C als druk 1,00?
Inzicht in oplosbaarheid
* oplosbaarheid Verwijst naar de maximale hoeveelheid van een stof (opgeloste stof) die kan oplossen in een bepaalde hoeveelheid een andere stof (oplosmiddel) bij een specifieke temperatuur en druk.
* Henry's Law regelt de oplosbaarheid van gassen in vloeistoffen. Het stelt dat de oplosbaarheid van een gas recht evenredig is met de partiële druk van dat gas boven de vloeistof.
Oxygen -oplosbaarheid berekenen
1. Henry's Law Constant: Je hebt de wet van de Henry constant nodig voor zuurstof in water bij 20 ° C. Deze waarde varieert enigszins afhankelijk van de bron, maar een gemeenschappelijke waarde is ongeveer 43,4 x 10^-3 mol/(l*atm) .
2. Gedeeltelijke druk: Je hebt de druk gegeven als 1,00, maar we moeten de eenheden kennen. Laten we aannemen dat het 1,00 atm (sfeer) is.
3. Berekening: Pas de wet van Henry toe:
* Oplosbaarheid (in mol/l) =Henry's wet constant x Gedeeltelijke druk
* Oplosbaarheid (in mol/l) =(43,4 x 10^-3 mol/(l * atm)) * (1,00 atm) =43,4 x 10^-3 mol/l
4. Converteer naar Millimolar:
* 1 mol/l =1000 mmol/l
* Oplosbaarheid (in mmol/l) =(43,4 x 10^-3 mol/l) * (1000 mmol/l/1 mol/l) =43,4 mmol/l
Daarom is de millimolaire oplosbaarheid van zuurstofgas (O2) in water bij 20 ° C en een druk van 1,00 atm ongeveer 43,4 mmol/l.
belangrijke opmerkingen:
* eenheden: Zorg ervoor dat uw eenheden tijdens uw berekening consistent zijn.
* Temperatuur: Oplosbaarheid is temperatuurafhankelijk. De wet van de Henry verandert constant met temperatuur, dus de oplosbaarheid zal anders zijn bij andere temperaturen.
* Factoren in de praktijk: Deze berekening biedt een theoretische waarde. In real-world scenario's kunnen andere factoren zoals de aanwezigheid van opgeloste zouten de werkelijke oplosbaarheid van zuurstof beïnvloeden.
 Frisse regenval teistert het door overstromingen getroffen zuiden van Brazilië terwijl het aantal evacuaties verdubbelt
Frisse regenval teistert het door overstromingen getroffen zuiden van Brazilië terwijl het aantal evacuaties verdubbelt  Waarom kan levende dingen niet geïsoleerd leven?
Waarom kan levende dingen niet geïsoleerd leven?  Het blootleggen van de impact van hydrologische gevoeligheid op de wereldwijde regenval
Het blootleggen van de impact van hydrologische gevoeligheid op de wereldwijde regenval  Hoe snel herstelt het klimaat?
Hoe snel herstelt het klimaat? Welk type straling zit vast op het aardoppervlak door het groene huiseffect?
Welk type straling zit vast op het aardoppervlak door het groene huiseffect?
Hoofdlijnen
- Welk type sporen produceert Selanginella?
- Kunnen we het evolutionaire concept van mensen toepassen?
- Wat is de evolutionaire ladder op orde?
- Wat noemde Gregor Mendel de eigenschappen die verdwijnen in de eerste generatie?
- Wat is een manier waarop eencellige organismen verschillen van multi-cellige organismen?
- Studie ontwikkelt nieuwe manier om kankercellen te identificeren
- Bij-nabootsende kaalvleugelmot zoemt na 130 jaar weer tot leven
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- Hoe zangvogels in opvallende kleuren een risico voor hen vormen
- Studie onthult nieuwe inzichten in hoe hybride perovskiet-zonnecellen werken

- De ringen van moleculen vormgeven
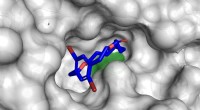
- Klimaatbescherming:CO2 omgezet in methanol
- Vetzuurgrondstoffen zorgen voor een zeer efficiënte glyoxylaat‐TCA-cyclus voor een hoogproductieve productie van β‐alanine

- Ladingsoverdracht binnen geanalyseerde overgangsmetaalkleurstoffen

 Tijdens welke faseverandering vereist water de meeste energie die in het milieu wordt vrijgegeven?
Tijdens welke faseverandering vereist water de meeste energie die in het milieu wordt vrijgegeven?  Wat gebeurt er als Light een gebogen stuk glas raakt?
Wat gebeurt er als Light een gebogen stuk glas raakt?  Is Shale Rock high of lage dichtheid?
Is Shale Rock high of lage dichtheid?  Agressieve en gewelddadige ontvoerders blijken beter toegerust om kinderen te ontvoeren
Agressieve en gewelddadige ontvoerders blijken beter toegerust om kinderen te ontvoeren Waarom worden schelpen soms kilometers in het binnenland gevonden?
Waarom worden schelpen soms kilometers in het binnenland gevonden?  Maankraters genoemd ter ere van Apollo 8
Maankraters genoemd ter ere van Apollo 8 QuadrantID's zijn te zien regenen door welk sterrenbeeld?
QuadrantID's zijn te zien regenen door welk sterrenbeeld?  Wetgeving die de maten banenplaneten geeft, wordt niet langer als een fysiek beschouwd omdat het?
Wetgeving die de maten banenplaneten geeft, wordt niet langer als een fysiek beschouwd omdat het?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

