
Wetenschap
Wat is de standaard enthalpieverandering van verbranding ethanol?
Dit is wat dat betekent:
* Enthalpy Change: Dit verwijst naar de warmte -energie die wordt vrijgegeven of geabsorbeerd tijdens een chemische reactie. Een negatieve enthalpiewijziging duidt op een exotherme reactie, waar warmte wordt vrijgegeven.
* verbranding: Dit is een chemisch proces waarbij de snelle reactie tussen een stof met een oxidatiemiddel, meestal zuurstof, betrokken is om warmte en licht te produceren.
* Standaardomstandigheden: Deze worden gedefinieerd als 298 K (25 ° C) en 1 atm druk.
* ethanol: De chemische formule voor ethanol is c₂h₅oh.
De evenwichtige chemische vergelijking voor de verbranding van ethanol is:
C₂h₅oh (l) + 3o₂ (g) → 2co₂ (g) + 3h₂o (l)
Deze vergelijking vertelt ons dat wanneer één mol ethanol volledig reageert met drie mol zuurstofgas, deze twee mol kooldioxide en drie mol water produceert. De enthalpieverandering geassocieerd met deze reactie is -1367 kJ/mol, wat betekent dat 1367 kJ warmte -energie wordt vrijgegeven voor elke mol verbrande ethanol.
 Wat is de kleinste eenheid van een stof die zich als inhoud gedraagt?
Wat is de kleinste eenheid van een stof die zich als inhoud gedraagt?  Kunnen bepaalde metalen haaien afweren van vistuig?
Kunnen bepaalde metalen haaien afweren van vistuig?  Waarom explodeert Soda in diepvriezers?
Waarom explodeert Soda in diepvriezers?  Een nieuwe workflow voor statistische modellen kan de ontdekking van geneesmiddelen en de synthetische chemie helpen bevorderen
Een nieuwe workflow voor statistische modellen kan de ontdekking van geneesmiddelen en de synthetische chemie helpen bevorderen  Wat is de directe overgang van vast ijs naar damp?
Wat is de directe overgang van vast ijs naar damp?
 Nieuwe toolvondsten en vingerafdrukken die voorheen onopgemerkte PFAS-verbindingen waren in stroomgebieden op Cape Cod
Nieuwe toolvondsten en vingerafdrukken die voorheen onopgemerkte PFAS-verbindingen waren in stroomgebieden op Cape Cod Geschreven op water:reconstructie van de oude geschiedenis van een oceaanstroom
Geschreven op water:reconstructie van de oude geschiedenis van een oceaanstroom Beschrijving van de vier soorten aquatische ecosystemen
Beschrijving van de vier soorten aquatische ecosystemen  4 visies op hoe technologie en innovatie de planeet zullen voeden
4 visies op hoe technologie en innovatie de planeet zullen voeden  Een hel vangen:orkaan Michael raast Florida binnen
Een hel vangen:orkaan Michael raast Florida binnen
Hoofdlijnen
- Wat noemde Gregor Mendel de eigenschappen die verdwijnen in de eerste generatie?
- Nieuwe inzichten over hoe de vogelgriep de soortbarrière overschrijdt
- Wat is recombinatie?
- Wetenschappers zetten een stap voorwaarts in het begrijpen hoe patiënten met chronische infecties met cystische fibrose kunnen worden aangepakt
- Wat zijn de twee belangrijkste soorten cellen die alle levende organismen vormen?
- Wat is fotosyntese?
- Wat zijn Agar Slants?
- Hoe wordt de aandoening genoemd waar aardworm zowel vrouwelijke als mannelijke geslachtsorganen heeft?
- Hebben gistcellen membraangebonden organellen?
- Rh-ensemblekatalysator voor effectieve behandeling van uitlaatgassen van auto's

- Onderzoekers identificeren meer mogelijke toegangspunten voor COVID-spike-eiwit
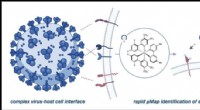
- Microfluïdisch systeem met celscheidende krachten kan ontrafelen hoe nieuwe pathogenen aanvallen
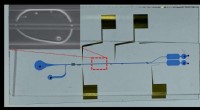
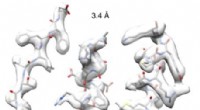
- Cryo-EM-beelden met hoge resolutie uit Afrika effenen de weg naar op maat gemaakte nitrilasen voor de industrie
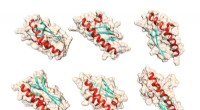
- De geboorte van een nieuw eiwit
 Welke berg brak uit in 1886?
Welke berg brak uit in 1886?  Nieuw apparaat voor optische niet-lineariteit veroorzaakt door symmetriebreking
Nieuw apparaat voor optische niet-lineariteit veroorzaakt door symmetriebreking Welk probleem heeft de microscoop opgelost?
Welk probleem heeft de microscoop opgelost?  Het IPCC oceans-rapport is een wake-up call voor beleidsmakers
Het IPCC oceans-rapport is een wake-up call voor beleidsmakers Hoe ver zou een bal van 1,00 kg moeten vallen om vrij snel de snelheid van 100 km per H te bereiken?
Hoe ver zou een bal van 1,00 kg moeten vallen om vrij snel de snelheid van 100 km per H te bereiken?  Hoe duidt de kleur aan de temperatuur van een ster?
Hoe duidt de kleur aan de temperatuur van een ster?  Is chemicaliën van planten chemische en fysische verwering?
Is chemicaliën van planten chemische en fysische verwering?  Wat zei Niel Armstrong toen hij op de maan landde?
Wat zei Niel Armstrong toen hij op de maan landde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

