
Wetenschap
Hoe kan de chemische activiteit van een element worden bepaald op basis van de locatie in de periodieke tabel?
1. Groep (kolom):
* Alkali -metalen (groep 1): Zeer reactief, verlies gemakkelijk één elektron om +1 kationen te vormen. Hun reactiviteit neemt de groep af.
* alkalische aardmetalen (groep 2): Reactief, verlies gemakkelijk twee elektronen om +2 kationen te vormen. Reactiviteit neemt de groep af.
* halogenen (groep 17): Zeer reactieve niet -metalen, krijgen gemakkelijk één elektron om -1 anionen te vormen. Reactiviteit neemt de groep af.
* nobele gassen (groep 18): Inert, zeer stabiel vanwege hun volledige buitenste elektronenschalen. Ze vormen zelden verbindingen.
2. Periode (rij):
* elektronegativiteit: De neiging van een atoom om elektronen aan te trekken in een binding neemt toe gedurende een periode (van links naar rechts) naarmate het aantal protonen in de kern toeneemt, wat leidt tot een sterkere aantrekkingskracht voor elektronen.
* ionisatie -energie: De energie die nodig is om een elektron uit een atoom te verwijderen, neemt toe gedurende een periode vanwege de sterkere aantrekkingskracht tussen de kern en elektronen.
* Metallic teken: Elementen aan de linkerkant van een periode zijn meer metaalachtig, terwijl elementen aan de rechterkant niet meer metalen zijn. Deze trend is gerelateerd aan elektronegativiteit en ionisatie -energie.
3. Andere factoren:
* Elektronenconfiguratie: De opstelling van elektronen in de buitenste schaal (valentie -elektronen) beïnvloedt direct de chemische reactiviteit. Elementen met een volledige buitenste schaal zijn zeer stabiel (edelgassen), terwijl elementen met gedeeltelijk gevulde schelpen reactiever zijn.
* Atomaire maat: De atoomgrootte neemt gedurende een periode af en verhoogt een groep. Kleinere atomen hebben een grotere aantrekkingskracht voor elektronen, wat leidt tot hogere reactiviteit.
* Afscherming: Binnen elektronen beschermen de buitenste elektronen van de nucleaire lading. Elementen met meer binnenste elektronen ervaren minder aantrekkingskracht van de kern, wat resulteert in lagere ionisatie -energie en hogere reactiviteit.
Voorbeeld:
* natrium (na) is in groep 1, wat betekent dat het een alkalimetaal is. Het heeft één valentie -elektron en verliest het gemakkelijk om een +1 kation te vormen, waardoor het zeer reactief is.
* chloor (Cl) is in groep 17, wat betekent dat het een halogeen is. Het heeft zeven valentie -elektronen en krijgt gemakkelijk één elektron om een -1 anion te vormen, waardoor het zeer reactief is.
Onthoud:
* Dit zijn algemene trends, en er zijn altijd uitzonderingen.
* Het periodieke tabel biedt een waardevol raamwerk voor het begrijpen van chemische reactiviteit, maar het is geen perfecte voorspeller.
Door deze trends en factoren te begrijpen, kunt u weloverwogen voorspellingen doen over de chemische activiteit van elementen op basis van hun locatie in de periodieke tabel.
 Bij onderzoek naar verkeersdoden in New Jersey wordt gekeken hoe dieren in het wild zich wel of niet door de Garden State verplaatsen
Bij onderzoek naar verkeersdoden in New Jersey wordt gekeken hoe dieren in het wild zich wel of niet door de Garden State verplaatsen  Na de lekkage van Deepwater Horizon:welke dieren hebben de ramp doorstaan?
Na de lekkage van Deepwater Horizon:welke dieren hebben de ramp doorstaan? Zes belangrijke punten over de regel voor betaalbare schone energie
Zes belangrijke punten over de regel voor betaalbare schone energie 11% van de vernietigde vochtige tropische bossen kan worden hersteld om het klimaat te verbeteren, omgeving
11% van de vernietigde vochtige tropische bossen kan worden hersteld om het klimaat te verbeteren, omgeving Hittegolf treft Irak - en de vonken slaan over
Hittegolf treft Irak - en de vonken slaan over
Hoofdlijnen
- Waarom missen planten de mobiele fagocytische cellen die typerend zijn voor dierlijke cellen?
- Welke organismen zijn in staat de energie van de zon om te zetten in chemische stoffen als voedsel?
- Wordt een volledig chromosoom tijdens transcriptie tot een mRNA gemaakt?
- Waarom hebben de meeste wetenschappers de hypothese van Wegeners afgewezen?
- Wat bevat het embryo?
- Het principe van individuele verschillen stelt dat de snelheids- en magnitude -aanpassingen aan training worden beperkt door uw verschillende genetica?
- Hoe de ziekteverwekker Mycobacterium tuberculosis zijn enige bekende exotoxine uitscheidt en distribueert
- Wat zijn alle bionomen?
- Zich in het volle zicht verbergen - Ontdekking roept vragen op over de schaal van de over het hoofd geziene biodiversiteit
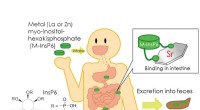
- Chemisch complex kan de uitscheiding van radioactief strontium uit het lichaam verbeteren
- Biobased hars:een doorbraak in rapid prototyping

- Chemicaliën kunnen hun identiteit veranderen, dankzij de vloeistoffen waar ze zich bevinden
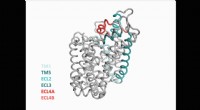
- Neurowetenschappers ontdekken nieuwe structuur van belangrijk eiwit in de hersenen
- Zelfherstellende katalysatorfilms voor waterstofproductie

 Stedelijke roltrap zorgt ervoor dat achtergestelde plattelandsstudenten topuniversiteiten mislopen
Stedelijke roltrap zorgt ervoor dat achtergestelde plattelandsstudenten topuniversiteiten mislopen Monitoring van CO2-lekkagelocaties op de oceaanbodem
Monitoring van CO2-lekkagelocaties op de oceaanbodem Wat voor soort energie heeft een toster?
Wat voor soort energie heeft een toster?  Het energetische landschap van zonnecellen in kaart brengen
Het energetische landschap van zonnecellen in kaart brengen Welk bewijs gebruikte Alfred Wegener om zijn theorie van de uiteenvallen Pangea te ondersteunen?
Welk bewijs gebruikte Alfred Wegener om zijn theorie van de uiteenvallen Pangea te ondersteunen?  Biogeochemische verbindingen in Groenland essentieel voor inzicht in het noordpoolgebied
Biogeochemische verbindingen in Groenland essentieel voor inzicht in het noordpoolgebied Hoe Pin Cherries in het wild te identificeren
Hoe Pin Cherries in het wild te identificeren  Wanneer een ruimteschip versnelt van 0 ms naar 60 noord in 3 seconden, wat is de versnelling van het ruimteschip?
Wanneer een ruimteschip versnelt van 0 ms naar 60 noord in 3 seconden, wat is de versnelling van het ruimteschip?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

