
Wetenschap
Chemicaliën kunnen hun identiteit veranderen, dankzij de vloeistoffen waar ze zich bevinden
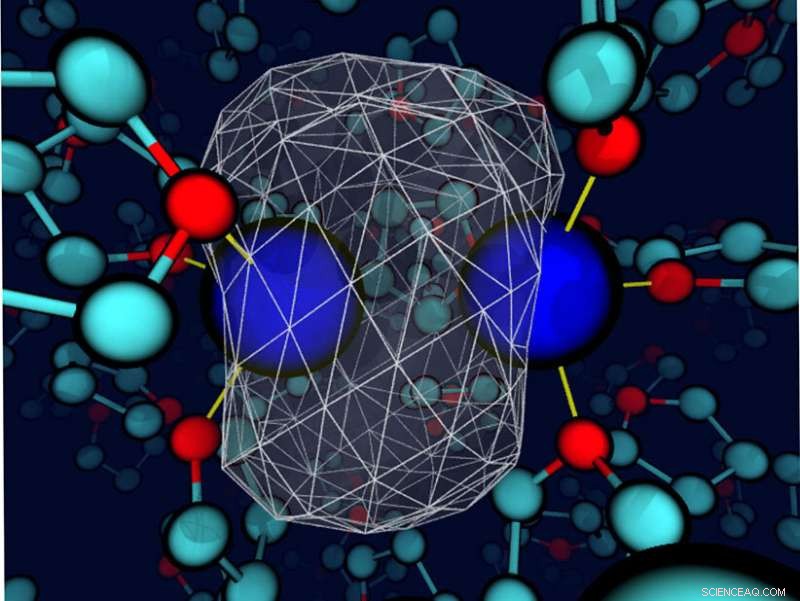
Een "momentopname" onthult dat het omringende tetrahydrofuran-oplosmiddel de bindingselektronendichtheid rond een natriumopgeloste stof vervormt. De natriumkernen zijn blauwe bollen; de dichtheid van de valentie-elektronen wordt weergegeven als een transparant wit oppervlak met een wit gaas dat het grootste deel van de ladingsdichtheid omsluit. De bindingen tussen natrium en de zuurstoflocaties in de buurt van het oplosmiddel zijn dunne gele lijnen. Krediet:Devon Widmer, Universiteit van Californië, Los Angeles
Gooi een paar hele amandelen in een pot vol hazelnoten. Schudden. De noten stuiteren tegen elkaar, maar ze reageren niet. Dat is hoe sommige mensen denken over reacties die plaatsvinden in vloeistoffen. De opgeloste stoffen (amandelen) reageren met elkaar in een zee van oplosmiddelen (hazelnoten). Maar een nieuwe studie toont aan dat dit niet altijd het geval is voor echte chemische reacties. Onder de juiste omstandigheden, het oplosmiddel kan de chemische identiteit van de opgeloste stof veranderen.
Veel chemische reacties, met name die welke relevant zijn voor het in leven houden van mensen en planten, in oplossing gebeuren. Dit onderzoek toont aan dat in veel van dergelijke reacties, het oplosmiddel is niet slechts een toeschouwer. Dat betekent dat de verwachtingen en rekenmodellen moeten worden aangepast. Omdat dezelfde regels kunnen gelden in scheikundelaboratoria, onderzoekers moeten hun oplosmiddelen mogelijk met meer zorg selecteren. De oplosmiddelen kunnen de chemische identiteit van de opgeloste stof controleren of veranderen.
Hoewel oplosmiddelen in sommige gevallen zorgvuldig worden geselecteerd, de vloeistoffen worden vaak eenvoudigweg als een medium beschouwd om de reactanten elkaar te laten ontmoeten. Echter, het oplosmiddel kan een grotere rol spelen. Hier, onderzoekers ontdekten dat wanneer het oplosmiddel en de opgeloste stof interageren (energetisch in dezelfde volgorde als een waterstofbrug), het oplosmiddel kan de bindingsdynamiek en de chemische identiteit van eenvoudige opgeloste stoffen regelen. De onderzoekers kwamen tot deze conclusie door een natriumdimeer in het zwak polaire oplosmiddel tetrahydrofuran te bestuderen. Bindingsinteracties tussen de oplosmiddel- en natriumatomen leidden tot unieke coördinatietoestanden. Deze staten moesten een vrije energiebarrière oversteken, in wezen een chemische reactie ondergaan, onderling te converteren. Verder, elke coördinatiestaat had zijn eigen dynamiek en spectroscopische handtekeningen. Hoewel scheikundigen zich al lang bewust zijn van de invloed van oplosmiddelen in bepaalde gevallen, dit onderzoek benadrukt de waarde van het zorgvuldig selecteren van het oplosmiddel om een specifieke omgeving te creëren in bepaalde chemische systemen met gecondenseerde fase.
 Kunstblad als minifabriek voor medicijnen
Kunstblad als minifabriek voor medicijnen Onderzoek naar de elektronische neus voor het bewaken van de luchtkwaliteit, diagnose van ziekte
Onderzoek naar de elektronische neus voor het bewaken van de luchtkwaliteit, diagnose van ziekte Plantafweerlaag heeft onverwacht effect op vluchtige stoffen, studie vondsten
Plantafweerlaag heeft onverwacht effect op vluchtige stoffen, studie vondsten Universiteit van Minnesota meldt doorbraak in 3D-printen voor herstel van het ruggenmerg
Universiteit van Minnesota meldt doorbraak in 3D-printen voor herstel van het ruggenmerg Rundvleespeptiden blokkeren bittere smaken
Rundvleespeptiden blokkeren bittere smaken
 Het eerste emissievrije onderzoeksstation van Antarctica toont aan dat duurzaam leven overal mogelijk is
Het eerste emissievrije onderzoeksstation van Antarctica toont aan dat duurzaam leven overal mogelijk is Geld praat bij het beïnvloeden van de klimaatveranderingswetgeving
Geld praat bij het beïnvloeden van de klimaatveranderingswetgeving Dit is het moment om je relatie met de natuur te heroverwegen
Dit is het moment om je relatie met de natuur te heroverwegen Nieuw bewijs voor pluim onder Yellowstone National Park
Nieuw bewijs voor pluim onder Yellowstone National Park NASA ziet Paul een overblijfsel van een lagedrukgebied worden
NASA ziet Paul een overblijfsel van een lagedrukgebied worden
Hoofdlijnen
- Waarom kan je jezelf niet kietelen?
- Research Paper Onderwerpen in Biochemistry
- Sorry,
- Studie:Grote witte haaien zwemmen steeds dieper
- Hoe creëren de hersenen een ononderbroken kijk op de wereld?
- "What Does Heterozygous Mean?
- Onderzoekers onthullen hoe stamcellen beslissingen nemen
- Wilde druivengist kan effectiever zijn dan pesticiden bij het voorkomen van druivenschimmels
- Hoe het Human Microbiome-project werkt
 Stellaire dief is de overlevende metgezel van een supernova
Stellaire dief is de overlevende metgezel van een supernova LIGO weer online, klaar voor meer ontdekkingen
LIGO weer online, klaar voor meer ontdekkingen Reactie voegt chirale groepen toe aan stikstofringen zonder eerst reactieve groepen te installeren
Reactie voegt chirale groepen toe aan stikstofringen zonder eerst reactieve groepen te installeren Geometrisch volume aan kinderen leren
Geometrisch volume aan kinderen leren Een quasideeltje doden:een kwantum-whodunit
Een quasideeltje doden:een kwantum-whodunit Wiskundigen zoeken uit hoe ze succes in de showbusiness kunnen voorspellen
Wiskundigen zoeken uit hoe ze succes in de showbusiness kunnen voorspellen Technologieoverschrijdende communicatie in het internet der dingen aanzienlijk vereenvoudigd
Technologieoverschrijdende communicatie in het internet der dingen aanzienlijk vereenvoudigd 10 mislukte persoonlijke vluchtpogingen
10 mislukte persoonlijke vluchtpogingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Norway | Italian | Danish |

-
Wetenschap © https://nl.scienceaq.com






