
Wetenschap
Wat is het proces van metalen die zuurstof verwijderen uit metaaloxide?
Hier is een uitsplitsing van het proces:
1. De reactie:
De algemene vergelijking voor reductie van een metaaloxide is:
metaaloxide + metaal → metaal + metaaloxide
De vermindering van ijzeroxide (FeO) met koolstof (C) kan bijvoorbeeld worden weergegeven als:
Feo + C → Fe + Co
2. Elektronenoverdracht:
Het metaal (in dit geval koolstof) fungeert als een reductiemiddel , het doneren van elektronen aan het metaaloxide.
* Koolstof verliest elektronen en wordt geoxideerd, waardoor koolmonoxide (CO) wordt gevormd.
* IJzeroxide wint elektronen en wordt verminderd, waardoor elementair ijzer (Fe) wordt gevormd.
3. Thermodynamica:
Het reductieproces wordt vaak uitgevoerd bij hoge temperaturen, wat de nodige energie biedt voor de reactie. Dit komt omdat het proces meestal het verbreken van chemische bindingen in het metaaloxide inhoudt.
4. Toepassingen:
Metaalreductie is een cruciaal proces in veel industriële toepassingen, waaronder:
* metallurgie: Metalen uit hun ertsen extraheren.
* chemische synthese: Het produceren van specifieke chemicaliën.
* katalyse: Als een stap in verschillende katalytische processen.
5. Voorbeelden:
Hier zijn enkele veel voorkomende voorbeelden van metaalreductieprocessen:
* hoogoven: Gebruikt om ijzererts (Fe₂o₃) te verminderen tot ijzeren metaal. Coke (koolstof) wordt gebruikt als het reductiemiddel.
* Thermietreactie: Een zeer exotherme reactie die aluminium (AL) gebruikt om ijzeroxide (Fe₂o₃) te verminderen tot gesmolten ijzer.
In wezen is reductie een proces dat zuurstof uit een metaaloxide verwijdert door elektronen naar het oxide over te brengen, wat leidt tot de vorming van het metaal in zijn elementaire vorm.
 Wat is de toestand van de materie als moleculen verder uit elkaar staan?
Wat is de toestand van de materie als moleculen verder uit elkaar staan?  Hoogwaardige nitridehalfgeleider voor milieuvriendelijke fotovoltaïsche energie
Hoogwaardige nitridehalfgeleider voor milieuvriendelijke fotovoltaïsche energie Hoe schrijf ik de gebalanceerde vergelijking waarin kaliumjodide reageert met chloor om chloride en jodium te vormen?
Hoe schrijf ik de gebalanceerde vergelijking waarin kaliumjodide reageert met chloor om chloride en jodium te vormen?  Welke factoren beïnvloeden de snelheid van een chemische reactie?
Welke factoren beïnvloeden de snelheid van een chemische reactie?  PH Meter versus PH Paper
PH Meter versus PH Paper
Hoofdlijnen
- Wetenschappers ontdekken waarom rijp fruit gevoeliger is voor necrotrofe ziekteverwekkers dan onrijp fruit
- Wat hebben vleermuizen, priesters en rabbijnen gemeen? Netwerkanalyse levert inzichten op
- Vergelijking & identificatie van kikkers en menselijke bloedcellen
- Wat is het woord dat u gebruikt om een groep gespecialiseerde organen te beschrijven?
- Hoe calciumionen in de cellulaire krachtcentrales van planten komen
- Kunnen planten ontkiemen met heet water?
- 1.700 jaar oude Koreaanse genomen vertonen genetische heterogeniteit in de Three Kingdoms-periode Gaya
- Basen van DNA zijn met elkaar verbonden door intermoleculaire krachten, genaamd?
- Wat heeft een persoon met een X -chromosoom en Y?
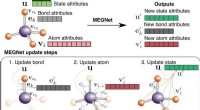
- Ingenieurs gebruiken grafieknetwerken om eigenschappen van moleculen en kristallen nauwkeurig te voorspellen
- Video:De chemie achter verschillende theesmaken

- Nieuwe test biedt nauwkeurige meting van DNA-schade door chemische verbindingen

- Hoog rijden? Chemici zetten stappen richting marihuana-ademanalysator

- Onderzoekers krijgen inzicht in hoe enzymen specifieke reacties bereiken
 Een worstelende recyclingindustrie wordt geconfronteerd met een nieuwe crisis met coronavirus
Een worstelende recyclingindustrie wordt geconfronteerd met een nieuwe crisis met coronavirus Wat zijn drie dingen die nodig zijn om fotosynthese te laten plaatsvinden?
Wat zijn drie dingen die nodig zijn om fotosynthese te laten plaatsvinden?  Nieuw partnerschap helpt duurzame groei met aardobservaties
Nieuw partnerschap helpt duurzame groei met aardobservaties Wat is de energietransformatie van een zaklamp?
Wat is de energietransformatie van een zaklamp?  Onderzoek draagt bij aan beleidswijzigingen om werknemers te ondersteunen tijdens de COVID-19-pandemie
Onderzoek draagt bij aan beleidswijzigingen om werknemers te ondersteunen tijdens de COVID-19-pandemie Een bodemtextuur wordt vastgehouden door?
Een bodemtextuur wordt vastgehouden door?  Hoe de kosten per Watt
Hoe de kosten per Watt Zo helder als... papier? Wetenschappers 'kijken' door vaste lagen heen
Zo helder als... papier? Wetenschappers 'kijken' door vaste lagen heen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

