
Wetenschap
Onderzoekers krijgen inzicht in hoe enzymen specifieke reacties bereiken
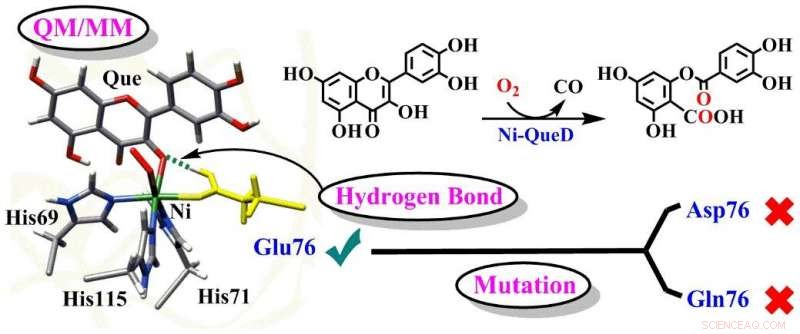
Schematische illustratie van de cruciale rollen van Glu76-residu in Ni-QueD. Credit:de groep van prof. LI
Katalytische dizuurstofactivering en selectieve oxidatieve splitsing van C-C-bindingen zijn de onderzoekshotspots op het gebied van chemie geworden vanwege hun grote toepassingswaarde in organische synthese en industriële productie.
Quercetine 2, 4-dioxygenasen (QueDs), als een typisch biologisch systeem van metallo-enzymen, kan efficiënt dizuurstof activeren en selectief de oxidatieve splitsing van C-C-bindingen van organische flavonolsubstraten katalyseren onder milde omstandigheden. Hoewel er al tientallen jaren onderzoek wordt gedaan naar QueD's, de gedetailleerde katalytische mechanismen van QueD's, vooral de rollen van het Glu76-residu op de actieve plaats, staan nog ter discussie.
In een studie gepubliceerd in de Dagboek van Katalyse , een groep onder leiding van prof. LI Chunsen van het Fujian Institute of Research on the Structure of Matter (FJIRSM) van de Chinese Academie van Wetenschappen rapporteerde de gedetailleerde mechanismen van reacties die worden gekatalyseerd door wild-type nikkelafhankelijke quercetine 2, 4-dioxygenase (Ni-QueD) en zijn Glu76Asp- en Glu76Gln-mutanten met behulp van gecombineerde MD-simulaties en QM/MM-berekeningen, en ze onthulden de cruciale rol van Glu76-residu bij het sturen van de reactiviteit van Ni-QueD.
De onderzoekers ontdekten dat het geconserveerde nikkel-ligerende Glu76-residu in de gedeprotoneerde vorm essentieel is voor het initiëren van de katalytische reactie door het proton-gekoppelde elektronenoverdrachtproces.
Het gegenereerde en geprotoneerde Glu76 bevordert de daaropvolgende reactie door de waterstofbinding (H-binding) interactie met de carbonylgroepen van quercetine te reguleren.
Onderzoeken van Glu76Gln- en Glu76Asp-mutanten tonen aan dat mutatie van Glu76 een dergelijke H-bindingsinteractie onderdrukt en resulteert in de lagere katalytische activiteit die experimenteel werd waargenomen.
Deze studie biedt niet alleen nuttige informatie over de mechanismen van reacties die worden gekatalyseerd door metaalion-afhankelijke QueD's, maar ook inzichten in hoe enzymen specifieke reacties bereiken door gebruik te maken van de H-bindingsinteractie van de metaalcentrum-ligerende residuen.
 Chemische doorbraken openen nieuwe deuren voor medicijnontwikkelaars en kankeronderzoekers
Chemische doorbraken openen nieuwe deuren voor medicijnontwikkelaars en kankeronderzoekers Methaan kansrijke route voor opslag duurzame energie uit zon en wind
Methaan kansrijke route voor opslag duurzame energie uit zon en wind Strontium-iridiumoxide gebruikt voor maatwerk als elektronisch materiaal
Strontium-iridiumoxide gebruikt voor maatwerk als elektronisch materiaal Van batterijafval tot elektrochemische sensor
Van batterijafval tot elektrochemische sensor Materiaalchemici tappen lichaamswarmte af om slimme kleding van stroom te voorzien
Materiaalchemici tappen lichaamswarmte af om slimme kleding van stroom te voorzien
 Nieuw onderzoeksnetwerk onderzoekt voorwaarden voor meer voedselzekerheid
Nieuw onderzoeksnetwerk onderzoekt voorwaarden voor meer voedselzekerheid Hoe stadsboeren leren voedsel te verbouwen zonder aarde of natuurlijk licht
Hoe stadsboeren leren voedsel te verbouwen zonder aarde of natuurlijk licht Wat zijn vraag- en aanbodsverschuivers?
Wat zijn vraag- en aanbodsverschuivers?  Onderzoekers vinden een manier om veranderingen in de snelheid van diepzeestromen in kaart te brengen met behulp van de meest bescheiden materialen - modder
Onderzoekers vinden een manier om veranderingen in de snelheid van diepzeestromen in kaart te brengen met behulp van de meest bescheiden materialen - modder Europa maakt zich op voor recordbrekende hittegolf
Europa maakt zich op voor recordbrekende hittegolf
Hoofdlijnen
- DNA-onderzoekers roepen botverzamelaars op om toegang tot botten te delen
- Darmbacteriën van wilde muizen stimuleren de gezondheid van laboratoriummuizen
- Verschil tussen een gesloten en open bloedsomloop
- Herstel van iconische inheemse vogel veroorzaakt problemen in stedelijke gebieden
- De nadelen van gelelektroforese
- Verschillen tussen codering en sjabloondraden
- Malariaparasiet verpakt genetisch materiaal voor reis van muggen naar mensen
- G2-fase: wat gebeurt er in deze subfase van de celcyclus?
- Wat is er nodig voor de glycolyse?
- Ontdekking van geheel nieuwe klasse RNA-caps in bacteriën
- Batterijmaterialen in kaart brengen met atomaire precisie
- Nat-droog cycli hadden de synthese van bouwstenen voor RNA op de vroege aarde mogelijk gemaakt

- Nieuwe technologie zet afvalplastic in een uur om in vliegtuigbrandstof

- Polymeermembranen vergemakkelijken de uitwisseling van zuurstof in het lichaam

 Nieuwe vorm van silicium kan elektronische en energie-apparaten van de volgende generatie mogelijk maken
Nieuwe vorm van silicium kan elektronische en energie-apparaten van de volgende generatie mogelijk maken Een nieuw licht schijnen op de evolutie van supernova's
Een nieuw licht schijnen op de evolutie van supernova's Nieuw onderzoek kan een revolutie teweegbrengen in de toekomst van elektronische apparaten
Nieuw onderzoek kan een revolutie teweegbrengen in de toekomst van elektronische apparaten Universiteiten annuleren studieprogramma's in het buitenland vanwege virusvrees
Universiteiten annuleren studieprogramma's in het buitenland vanwege virusvrees Een elektromagneet maken met een batterij, nagel en draad
Een elektromagneet maken met een batterij, nagel en draad Californische kreekbrand creëert zijn eigen pyrocumulonimbus-wolk
Californische kreekbrand creëert zijn eigen pyrocumulonimbus-wolk Onderzoekers creëren vermoeidheidsvrije, rekbare geleider
Onderzoekers creëren vermoeidheidsvrije, rekbare geleider Vergrijzing zal de groei in Azië afremmen:IMF-chef
Vergrijzing zal de groei in Azië afremmen:IMF-chef
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

