
Wetenschap
Kan een geladen atoom neutraal atoom aantrekken?
* geladen atoom: Het geladen atoom heeft een ongelijke verdeling van elektronen, waardoor een regio van positieve lading en een regio van negatieve lading ontstaat.
* Neutraal atoom: Het neutrale atoom heeft een evenwichtige verdeling van elektronen, maar de elektronen kunnen enigszins worden verschoven in reactie op een extern elektrisch veld.
* Attractie: Wanneer het geladen atoom het neutrale atoom nadert, trekt het elektrische veld uit het geladen atoom de elektronen in het neutrale atoom. Dit verschuift de elektronen in het neutrale atoom naar de tegenovergestelde lading van het geladen atoom, waardoor een tijdelijk dipoolmoment in het neutrale atoom ontstaat. De tegenovergestelde ladingen trekken aan, wat resulteert in een algehele aantrekkelijke kracht tussen de twee atomen.
Voorbeeld:
Stel je een positief geladen natriumion (Na+) voor die een neutraal watermolecuul nadert (H2O). De positieve lading op het natriumion zal het negatief geladen zuurstofatoom in het watermolecuul aantrekken, waardoor het watermolecuul zich uitlijnt met zijn zuurstofuiteinde dat wijst op het natriumion. Deze tijdelijke uitlijning creëert een aantrekkelijke kracht tussen de twee.
Belangrijke opmerking: De sterkte van de aantrekkingskracht hangt af van verschillende factoren:
* lading van het geladen atoom: Een hogere lading leidt tot een sterkere aantrekkingskracht.
* Afstand tussen de atomen: Dichtere atomen ervaren een sterkere aantrekkingskracht.
* Polariseerbaarheid van het neutrale atoom: Atomen met gemakkelijker verschoven elektronen (meer polariseerbaar) worden sterker aangetrokken.
Over het algemeen, hoewel een neutraal atoom geen netto -lading heeft, kan het nog steeds worden aangetrokken door een geladen atoom vanwege het polarisatie -effect. Deze aantrekkingskracht is cruciaal voor veel chemische en biologische processen, zoals de vorming van ionische bindingen en de interactie van ionen met biologische moleculen.
Hoofdlijnen
- Een complex koolhydraat dat bekend staat als zetmeel is gemaakt van herhalende monomeereenheden wat?
- Wat wordt de naam gegeven om te verwerken wanneer mannelijke en felmale sekscellen smelten?
- Wat is variabele van de wetenschappelijke methode?
- Waarom zijn er geen Eenhoorns?
- Fermentatie treedt op wanneer een cel wordt?
- Waarom zoveel dieren, inclusief onze huisdieren, een derde ooglid hebben, maar mensen niet
- Wetenschappers ontdekken hoe een groep rupsen giftig werd
- Wat is voedselgewas?
- Zijn gameten geassocieerd met diploïde chromosomen?
- Onderzoekers pleiten voor hernieuwde focus op thermo-elektrische koeling

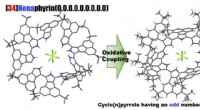
- Synthese van een bijna-infrarood lichtabsorberende macrocyclische aromatische verbinding
- Zullen lithium-luchtbatterijen ooit vliegen?

- Eerder onbekende kristallijne fase van halfwaterig calciumcarbonaat ontdekt

- Spoor, doelwit, trigger:wetenschappers onderzoeken gecontroleerde CO-afgifte
 Journalistieke vrouwen van kleur hebben meer kans op gewelddadige, seksuele intimidatie
Journalistieke vrouwen van kleur hebben meer kans op gewelddadige, seksuele intimidatie Hoe diabetes werkt
Hoe diabetes werkt  Wat gebeurt er langs de Mid-Atlantic Ridge?
Wat gebeurt er langs de Mid-Atlantic Ridge?  Een door kracht aangedreven mechanisme voor het vaststellen van celpolariteit
Een door kracht aangedreven mechanisme voor het vaststellen van celpolariteit Wat is de naam voor een snelheid in zijn baan?
Wat is de naam voor een snelheid in zijn baan?  Hoeveel energie van de zon bereikt daadwerkelijk maïs?
Hoeveel energie van de zon bereikt daadwerkelijk maïs?  Feiten over de Stick Caterpillar
Feiten over de Stick Caterpillar  Wat zijn de drie belangrijkste soorten magma en welke factor bepaalt deze classificaties?
Wat zijn de drie belangrijkste soorten magma en welke factor bepaalt deze classificaties?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


