
Wetenschap
Wat zijn gepolariseerde moleculen?
gepolariseerde moleculen:ongelijke verdeling van lading
Gepolariseerde moleculen, ook bekend als polaire moleculen , zijn moleculen met een ongelijke verdeling van elektrische lading . Dit betekent dat het ene uiteinde van het molecuul een enigszins positief draagt lading, terwijl het andere uiteinde een enigszins negatief draagt aanval. Deze scheiding van lading creëert een dipoolmoment .
Hoe gebeurt dit?
* elektronegativiteit: De ongelijke verdeling van lading ontstaat als gevolg van verschillen in elektronegativiteit tussen de atomen die het molecuul vormen. Elektronegativiteit is het vermogen van een atoom om elektronen in een binding aan te trekken.
* Polaire bindingen: Wanneer twee atomen met verschillende elektronegativiteiten binden, trekt het meer elektronegatief atoom de gedeelde elektronen sterker aan, wat leidt tot een polaire covalente binding . Dit creëert een gedeeltelijke negatieve lading in de buurt van het meer elektronegatieve atoom en een gedeeltelijke positieve lading nabij het minder elektronegatieve atoom.
* Moleculaire geometrie: De vorm van het molecuul speelt ook een rol. Als de polaire bindingen asymmetrisch in het molecuul zijn gerangschikt, annuleren de individuele binddipolen elkaar niet uit, wat resulteert in een netto dipoolmoment en een gepolariseerd molecuul.
Voorbeelden van polaire moleculen:
* water (h₂o): Zuurstof is elektronegatiefer dan waterstof, waardoor polaire bindingen ontstaan. De gebogen vorm van het watermolecuul betekent dat de binddipolen niet worden geannuleerd, wat resulteert in een netto dipoolmoment.
* ammoniak (NH₃): Stikstof is elektronegatiefer dan waterstof, waardoor polaire bindingen ontstaan. De piramide -vorm van het ammoniakmolecuul betekent dat de binddipolen niet worden geannuleerd, wat resulteert in een netto dipoolmoment.
* waterstofchloride (HCl): Chloor is elektronegatiefer dan waterstof, waardoor een polaire binding ontstaat. De lineaire vorm van het molecuul resulteert in een netto dipoolmoment.
Belang van polaire moleculen:
Polaire moleculen hebben unieke eigenschappen die ze essentieel maken in veel biologische en chemische processen. Enkele voorbeelden zijn:
* Oplosbaarheid: Polaire moleculen zijn over het algemeen oplosbaar in andere polaire oplosmiddelen zoals water.
* intermoleculaire krachten: Polaire moleculen vertonen sterkere intermoleculaire krachten zoals waterstofbinding, die hun smelt- en kookpunten beïnvloeden, en fysieke toestand bij kamertemperatuur.
* Biologische processen: Polaire moleculen zijn betrokken bij cruciale biologische processen zoals eiwitvouwen, enzymactiviteit en celsignalering.
In tegenstelling tot polaire moleculen hebben niet -polaire moleculen een gelijkmatige verdeling van lading en geen netto dipoolmoment.
Inzicht in het concept van gepolariseerde moleculen is cruciaal voor het begrijpen van het gedrag en de eigenschappen van verschillende stoffen en hun interacties in verschillende omgevingen.
 Hoeveel liter vloeibaar petroleumgas levert één kg gas op?
Hoeveel liter vloeibaar petroleumgas levert één kg gas op?  Wat betekenen de grote getallen in een chemische vergelijking?
Wat betekenen de grote getallen in een chemische vergelijking?  Als 2,10 g NaHCO3 wordt afgebroken, hoeveel gram water wordt er dan geproduceerd?
Als 2,10 g NaHCO3 wordt afgebroken, hoeveel gram water wordt er dan geproduceerd?  Halfgeleiders bundelen krachten in fotokatalyse
Halfgeleiders bundelen krachten in fotokatalyse Oplosmiddel dat in staat is om grasvlekken te verwijderen?
Oplosmiddel dat in staat is om grasvlekken te verwijderen?
Hoofdlijnen
- Zijn biologische gewassen net zo productief als conventioneel?
- Wat zijn de bouwstenen van ATP?
- Wat is de wetenschappelijke term voor het creëren van glycogeen?
- Hoe gebruiken plantencellen flagella?
- Kenmerken van ATP
- Waarom gaan cellen door celdeling?
- Vlezige structuur rondom het zaad in een angiosperm?
- Nieuw onderzoek laat zien hoe amyloïde bèta de hersencellen binnendringt
- Zijn schimmelcelnulceus aanwezig of afwezig?
- Wetenschappers ontwikkelen apparaat om namaak drank te detecteren

- filmpje:natto, de stinkende, slijmerige sojabonensnack

- Een hybride materiaal dat omkeerbaar schakelt tussen twee stabiele vaste toestanden
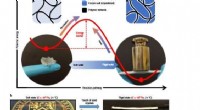
- De toevallige ontdekking van een nieuwe groene chemiemethode

- Het beste van twee werelden:twee skeletvormende chemische reacties combineren
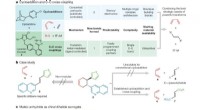
 Vrijwilligerstoerisme kan helpen bij rampenherstel
Vrijwilligerstoerisme kan helpen bij rampenherstel Hoe Finland omarmde om ‘de gelukkigste natie ter wereld’ te zijn
Hoe Finland omarmde om ‘de gelukkigste natie ter wereld’ te zijn  Wat is het belangrijkste verschil tussen geocentrische en helicentrische modellen van het zonnestelsel?
Wat is het belangrijkste verschil tussen geocentrische en helicentrische modellen van het zonnestelsel?  Wat is de elektronencapaciteit van de tweede schil?
Wat is de elektronencapaciteit van de tweede schil?  Natuurlijke bronnen van water
Natuurlijke bronnen van water  Nanobuisjes vormen een gezondheidsrisico, studie toont
Nanobuisjes vormen een gezondheidsrisico, studie toont Heb je meer kans om verkeerde informatie over Oekraïne of COVID-19 te geloven?
Heb je meer kans om verkeerde informatie over Oekraïne of COVID-19 te geloven? Hoeveel atomen zijn er in 62 mol zilver?
Hoeveel atomen zijn er in 62 mol zilver?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

