
Wetenschap
Welk type binding verklaart waarom methanol een veel hoger kookpunt heeft dan methaan?
Dit is waarom:
* methanol heeft een hydroxylgroep (OH): Deze groep bevat een sterk elektronegatief zuurstofatoom dat is gebonden aan een waterstofatoom. Het zuurstofatoom trekt de gedeelde elektronen in de binding aan, waardoor een gedeeltelijke negatieve lading op de zuurstof en een gedeeltelijke positieve lading op de waterstof ontstaat.
* waterstofbinding: Het gedeeltelijk positieve waterstofatoom in één methanolmolecuul kan een sterke elektrostatische interactie vormen met het gedeeltelijk negatieve zuurstofatoom van een ander methanolmolecuul. Deze interactie wordt een waterstofbinding genoemd.
* Sterkere intermoleculaire krachten: Waterstofbindingen zijn veel sterker dan de van der Waals -krachten die aanwezig zijn tussen methaanmoleculen. Deze sterke intermoleculaire krachten vereisen meer energie om te overwinnen, wat resulteert in een hoger kookpunt voor methanol.
daarentegen:
* methaan heeft alleen C-H-bindingen: Deze bindingen zijn niet -polair, wat betekent dat er geen significant verschil is in elektronegativiteit tussen koolstof en waterstof. Dit gebrek aan polariteit voorkomt de vorming van sterke waterstofbruggen.
* Zwakkere intermoleculaire krachten: Methaanmoleculen worden alleen bij elkaar gehouden door zwakke Van der Waals -krachten. Deze krachten zijn gemakkelijk te overwinnen, wat leidt tot een veel lager kookpunt.
Daarom is het vermogen van methanol om waterstofbruggen te vormen vanwege de aanwezigheid van de hydroxylgroep de primaire reden voor het aanzienlijk hogere kookpunt in vergelijking met methaan.
 Machine learning stroomlijnt het zoeken naar efficiëntere chemische reacties drastisch
Machine learning stroomlijnt het zoeken naar efficiëntere chemische reacties drastisch Een monster van een verbinding bevat 64 gram koper en 16 gram zuurstof. Wat is de verhouding tussen massa en zuurstof?
Een monster van een verbinding bevat 64 gram koper en 16 gram zuurstof. Wat is de verhouding tussen massa en zuurstof?  Welk subatomair deeltje heeft een positieve lading waar in het atoom?
Welk subatomair deeltje heeft een positieve lading waar in het atoom?  Wat is de atoommassa van sulfaat?
Wat is de atoommassa van sulfaat?  Wie heeft de ideale gaswet gecreëerd?
Wie heeft de ideale gaswet gecreëerd?
Hoofdlijnen
- Wetenschappers onthullen hoe een belangrijk kankerdoelwit de verspreiding zou kunnen stoppen
- Nieuw onderzoek laat producenten zien waar en hoe ze cellulosebiobrandstofgewassen kunnen verbouwen
- Genduplicatie die de celdeling lijkt te vertragen, zorgt ervoor dat Groenlandse walvissen langer leven
- Fokbiologie van gigantische Australische mihirung-vogels maakte de weg vrij voor uitsterven
- Zou er een probleem zijn als het RNA -polymerase een verkeerde streng DNA -streng zou transcriberen en cel probeerde te maken?
- Wilde genen bij gedomesticeerde soorten:hoe we onze gewassen een boost kunnen geven met behulp van hun verre verwanten
- Wat gebeurt er met de meeste organismen als ze sterven?
- Welke suiker componeert een deel van het ATP -molecuul?
- Mengen de Atlantische en de Stille Oceaan zich?
- DNA buigen kost minder energie dan aangenomen
- Korrelig aluminium voor toekomstige computers
- Onderzoek toont aan hoe kleine compartimenten aan cellen vooraf konden gaan

- Detectie van een nieuw reactiepad in de atmosfeer

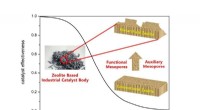
- Rationeel ontwerpen van hiërarchische zeolieten voor betere diffusie en katalysatorefficiëntie
 Over de oorsprong van de landbouw, onderzoekers ontdekken nieuwe aanwijzingen
Over de oorsprong van de landbouw, onderzoekers ontdekken nieuwe aanwijzingen Wat is de theorie voor de oorsprong van planetaire ringdeeltjes?
Wat is de theorie voor de oorsprong van planetaire ringdeeltjes?  Waarom is een spoel van transformator koper gemaakt?
Waarom is een spoel van transformator koper gemaakt?  Wat gebeurt er met volume als de druk wordt verdubbeld?
Wat gebeurt er met volume als de druk wordt verdubbeld?  Soorten sterrenstelsels:waarom sterrenstelsels verschillende vormen hebben
Soorten sterrenstelsels:waarom sterrenstelsels verschillende vormen hebben  Nanovezelcoating voorkomt infecties van prothesegewrichten
Nanovezelcoating voorkomt infecties van prothesegewrichten De luchtkwaliteit op veel treinstations is alarmerend slecht. Hier leest u hoe u deze kunt verbeteren
De luchtkwaliteit op veel treinstations is alarmerend slecht. Hier leest u hoe u deze kunt verbeteren  Geïntercaleerd water verwijderen uit met stikstof gedoteerde grafeenoxideplaten
Geïntercaleerd water verwijderen uit met stikstof gedoteerde grafeenoxideplaten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

