
Wetenschap
Wat is de betekenis van een elektronegativiteitsverschil tussen 1,7 en 2 atomen?
* elektronegativiteit: Deze eigenschap meet het vermogen van een atoom om elektronen aan te trekken in een chemische binding. Hoe hoger de elektronegativiteit, hoe sterker de trek op gedeelde elektronen.
* bindingstypen:
* Niet -polaire covalent: Wanneer twee atomen vergelijkbare elektronegativiteiten hebben, delen ze elektronen redelijk gelijk, wat resulteert in een niet -polaire binding.
* Polar covalent: Wanneer er een verschil is in elektronegativiteit, trekt het atoom met hogere elektronegativiteit de gedeelde elektronen sterker aan. Dit creëert een gedeeltelijke negatieve lading (Δ-) op dat atoom en een gedeeltelijke positieve lading (δ+) op het andere atoom. Deze ongelijke elektronenverdeling creëert een polaire binding .
* ionisch: Wanneer het elektronegativiteitsverschil groot is (meestal groter dan 2,0), steelt het meer elektronegatief atoom in wezen het elektron van het andere atoom, waardoor ionen en een ionische binding ontstaan.
* Betekenis:
* polariteit: Polaire covalente bindingen leiden tot polaire moleculen, die een positief en negatief einde hebben. Deze polariteit is cruciaal voor veel chemische interacties, waaronder:
* Oplosbaarheid: Polaire moleculen hebben de neiging om op te lossen in polaire oplosmiddelen (zoals water), terwijl niet -polaire moleculen oplossen in niet -polaire oplosmiddelen (zoals olie).
* intermoleculaire krachten: Polaire moleculen hebben sterkere intermoleculaire krachten dan niet -polaire moleculen, wat leidt tot hogere smeltpunten en kookpunten.
* Chemische reactiviteit: Polaire moleculen kunnen verschillende chemische reacties aangaan dan niet -polaire moleculen.
Voorbeelden:
* h-cl: Elektronegativiteitsverschil ≈ 0,9 (polaire covalente binding)
* C-O: Elektronegativiteitsverschil ≈ 1,0 (polaire covalente binding)
* Na-Cl: Elektronegativiteitsverschil ≈ 2.1 (ionische binding)
Samenvattend, Een elektronegativiteitsverschil tussen 1,7 en 2,0 duidt op een binding waarbij elektronen ongelijk worden gedeeld, waardoor een polaire covalente binding ontstaat. Deze polariteit heeft significante implicaties voor de eigenschappen en reactiviteit van het resulterende molecuul.
Hoofdlijnen
- Waarom blijven liedjes in mijn hoofd hangen?
- Wat is de drijvende kracht achter de menselijke evolutie?
- Wat is soorten met blond haar en blauwe of bruine ogen?
- Wat is vergelijkende biochemie?
Vergelijkende biochemie kan een vaag begrip zijn met meerdere betekenissen, alhoewel het boeiende interacties tussen organismen en hun biologieën kan onthullen. Op zijn minst noemen wetenschappers het een interdiscip
- Oorsprong van het leven? Ontdekking zou kunnen helpen verklaren hoe de eerste organismen op aarde ontstonden
- Hoe kan het begrijpen van verkeerd gevouwen eiwitten de behandeling van ziekten helpen verbeteren?
- De kleinste krachten opsporen:hoe T-cellen indringers detecteren
- Wat is het belangrijkste onderdeel van het wetenschappelijke proces?
- Hoe worden protista geclassificeerd?
- De geheimen van Tennessee whisky ontrafelen

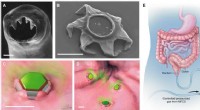
- Gastro-intestinaal-bewoner, vormveranderende microdevices voor verlengde medicijnafgifte
- Onderzoekers ontwikkelen nieuwe moleculaire ferro-elektrische metamaterialen

- Luchtstabiele intrinsiek rekbare kleurconversielagen voor rekbare displays

- Video:Zal het cryogeen bevriezen en weer tot leven komen ooit werkelijkheid worden?

 Lego spelen op atomaire schaal
Lego spelen op atomaire schaal Laat zien hoe de kleinste deeltjes in ons universum ons hebben gered van volledige vernietiging
Laat zien hoe de kleinste deeltjes in ons universum ons hebben gered van volledige vernietiging Waar is de Voyager 2?
Waar is de Voyager 2?  Wat was het dominante dier van Krijtperiode?
Wat was het dominante dier van Krijtperiode?  Seismische golf die ervoor zorgt dat de grond in twee richtingen bewoog?
Seismische golf die ervoor zorgt dat de grond in twee richtingen bewoog?  Waar worden eiwitten in het lichaam gevonden?
Waar worden eiwitten in het lichaam gevonden?  Waar bevond de zon zich in de eerste kaarten van Melkweg?
Waar bevond de zon zich in de eerste kaarten van Melkweg?  Welk gesteente is de belangrijkste bron van aluminium?
Welk gesteente is de belangrijkste bron van aluminium?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


