
Wetenschap
Gastro-intestinaal-bewoner, vormveranderende microdevices voor verlengde medicijnafgifte
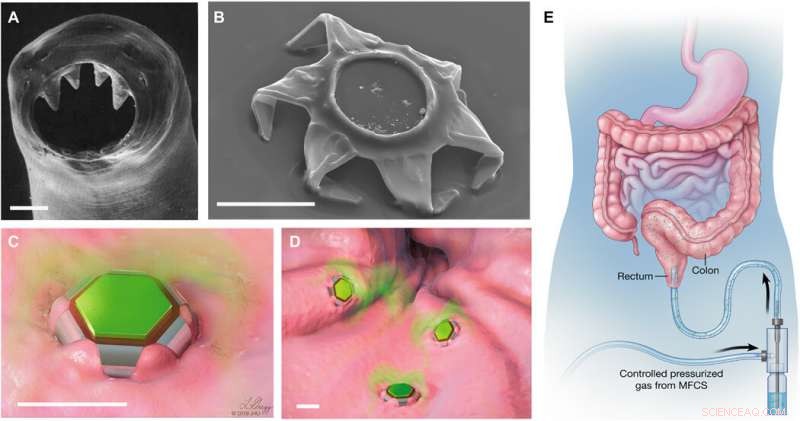
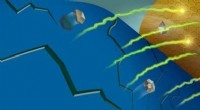
Vormveranderende theragrippers als zelfvergrendelende apparaten voor medicijnafgifte. (A) Scanning elektronenmicroscopie (SEM) beeld van de ventriculaire tanden van mijnworm A. duodenale. De worm gebruikt deze scherpe tanden om door het slijmvlies te dringen en hecht zich tot 2 jaar in het maagdarmkanaal. Herdrukt uit Human Parasitology, 4e druk. Auteursrecht 2013, met toestemming van Elsevier. (B) SEM-beeld van een theragripper in de gesloten configuratie. Zoals de haakworm, de theragrippers zijn voorzien van scherpe microtips. Schematische illustraties van (C) een enkele en (D) veel theragrippers die aan het slijmvliesweefsel zijn bevestigd en ingekapseld medicijn vrijgeven (groen gekleurd). Schaalbalken, 100 m (A tot D). (E) Conceptuele illustratie van de rectale toediening van met medicijnen geladen theragrippers met behulp van een drukgestuurde microfluïdische stroomregelaar. Afbeeldingen (C) tot (E) werden geïllustreerd door L. Gregg. MFCS, microfluïdisch stroomregelsysteem. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb4133
Het online coververhaal van wetenschappelijke vooruitgang deze week bevat een conceptueel gastro-intestinaal (GI) microdevice, ontwikkeld door een onderzoeksteam voor verlengde medicijnafgifte. Het is bewezen dat platforms voor medicijnafgifte voor verlengde medicijnafgifte een uitdaging zijn om te ontwikkelen in bio-engineering vanwege bewegingen van het maagdarmkanaal (GI) en de daaruit voortvloeiende eliminatie uit het lichaam. In een nieuw rapport Arijit Ghosh en een team van interdisciplinaire onderzoekers in chemische en biomoleculaire engineering, gastro-enterologie en hepatologie, materiaal kunde, medicijnontdekking en neurologie aan de Johns Hopkins University in de VS rapporteerde nieuwe met medicijnen geladen apparaten die bio-geïnspireerd zijn door de grijpmechanismen van parasitaire rondwormen die bekend staan als haakwormen. De parasieten kunnen gedurende langere tijd in de dunne darm blijven hangen en zich voeden met het bloed van hun gastheer.
Ghosh et al. ontwierpen en ontwikkelden een aangrijpende constructie die ze theragrippers noemden om hun klauwen in het slijmvlies van het darmkanaal te graven. De apparaten grepen aan als reactie op lichaamswarmte of andere biologische signalen en gaven medicijnen vrij in het GI-lumen. Als proof-of-concept, ze toonden aan hoe de apparaten 24 uur lang aan het maagdarmkanaal van levende ratten vasthielden en toonden een zesvoudige toename van de eliminatiehalfwaardetijd van een niet-steroïde anti-inflammatoir geneesmiddel dat wordt gebruikt om matige pijn te verlichten. Het werk toonde aan dat het apparaat het medicijn hielp om voor een aanzienlijk langere tijd in het lichaam te blijven. Het werk levert eersteklas bewijs over zelfvergrendelende microdevices om langdurige en verbeterde medicijnafgifte effectief te verbeteren.
Geneesmiddelen toedienen in het maagdarmkanaal
In dit werk, Ghosh et al. werden geïnspireerd door het biomechanisme van Ancylostoma duodenale (haakwormen) die tot twee jaar in de menselijke darm verblijven. Het werk presenteerde het eerste preklinische bewijs van vergrendelingshulpmiddelen op submillimeterschaal voor verbeterde afgifte en retentie van geneesmiddelen in vivo. Toediening van geneesmiddelen via het maagdarmkanaal kan de therapietrouw verbeteren in vergelijking met injectables, wat resulteert in een betere behandeling. Geneesmiddelen die via het maagdarmkanaal worden toegediend, zorgen voor een efficiënte absorptie en systemische circulatie dankzij het enorme darmoppervlak en de rijke vascularisatie van het slijmvlies van het maagdarmkanaal. Bijvoorbeeld, wetenschappers hadden eerder mucuspenetrerende deeltjes (MPP's) ontwikkeld voor een betere retentie, hoewel dergelijke apparaten na een dag werden verwijderd vanwege het opruimen van de onderliggende slijmlaag. Er bestaat daarom momenteel een dringende behoefte om uitgebreide medicijnafgiftesystemen te ontwikkelen.
Schematische weergave van op haakwormen geïnspireerde microdevices die verlengde medicatie verbeterden Schematische weergave van op haakwormen geïnspireerde microdevices die verlengde medicijnafgifte bij ratten verbeterden. Afbeelding tegoed:Lydia Gregg 2020 JHU, wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb4133 levering bij ratten. Afbeelding tegoed:Lydia Gregg 2020 JHU, wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb4133
Het experiment:Theragrippers ontwikkelen
Om automatische vergrendeling in het GI-lumen te bereiken, Ghosh et al. vertrouwden op de thermisch geactiveerde vrijgave van het apparaat. Ze bevestigden een pleister voor het laden van medicijnen op de microactuators om ketorolac (een pijnstiller) als modelmedicijn af te geven. De theragrippers werden 24 uur in de dikke darm vastgehouden, waardoor aanzienlijke blootstelling aan het medicijn, resulterend in een 10 keer hogere ketorolac-plasmaconcentratie 12 uur na toediening. Het proof-of-concept werk valideerde de actieve, vormveranderende en zelfsluitende theragrippers voor verlengde medicijnafgifte in het maagdarmkanaal. De wetenschappers gebruikten meerdere scherpe microtips om de theragrippers te ontwerpen die ervoor zorgden dat ze zich aan het GI-slijmvlies hechten, net als haakwormen. Ze bedekten de dikke, stijve segmenten en dubbellaagse scharnieren van de theragrippers met een warmtegevoelige waslaag. De paraffine- of waslaag aan het oppervlak van het apparaat werd na implantatie zachter bij lichaamstemperatuur om autonoom de klauwen in het maagdarmkanaal van het diermodel te activeren.
Het team gebruikte hybride materialen met een metaalpolymeer gemaakt van goud en chroom en met een medicijn-eluerende polymeerpleister voor de gecontroleerde afgifte van medicijnen. De kleefkracht van het met geneesmiddel beladen polymeer aan de onderliggende metalen steiger verhinderde delaminatie (verwijdering) van de geneesmiddelpleister tijdens GI-peristaltiek. De materialen waren biocompatibel zonder potentiële toxiciteit voor medicijnafgifte. Het team selecteerde de rectale toedieningsweg van het apparaat die het meest voorkomt bij pediatrische patiënten en bij therapeutische interventies voor colitis ulcerosa.
Fluoresceïne maakte visualisatie van chemische afgifte van theragrippers mogelijk. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb4133 
Ghosh et al. eerst de porositeit van de elektrolytische pleister op het apparaat afgesteld om geneesmiddelen gedurende 24 uur te laden en af te geven. Ze gebruikten ketorolac, een door de Amerikaanse Food and Drug Administration goedgekeurde, niet-steroïde, ontstekingsremmend geneesmiddel als modelkandidaat met een hoog klaringsprofiel (halfwaardetijd van minder dan 3 uur) voor in vivo experimenten in een knaagdiermodel. De poriegrootte van het polymeer vergemakkelijkte de afgifte van aanzienlijke hoeveelheden ketorolac met een aanvaardbare snelheid, en het team gebruikte theragrippers van 250 m voor in vivo medicijnafgifte bij ratten. De constructen waren 32 keer kleiner dan de typische colondiameter bij ratten en wogen ongeveer 300 g. Ghosh et al. de penetratie van de theragripper afgesteld door de parameters van het construct te variëren, en gebruikte de eindige-elementenmethode om de kracht te schatten die wordt gegenereerd door de vouwklauwen van het apparaat. Het team paste een beperking toe aan de punt van de theragripper om te voorkomen dat deze tijdens de simulaties vouwde en berekende de geschatte druk van elke theragripper-microtip op de dikke darm - die in het bereik van 0,4 tot 0,6 MPa lag. De resultaten wezen op hun potentieel om voldoende druk uit te oefenen om de mucosale barrière te doorbreken zonder de dikke darm te beschadigen.
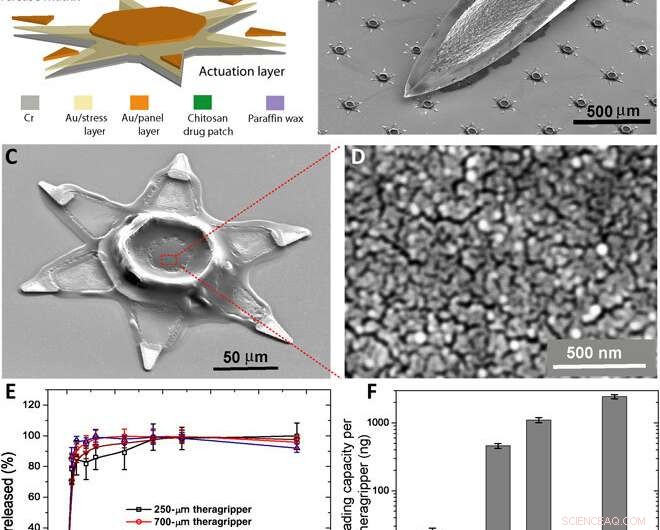
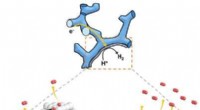
Parallelle fabricage van de theragrippers en hun in vitro eigenschappen voor het laden en vrijgeven van geneesmiddelen. (A) Functioneel blokdiagram dat de microfabricagestappen illustreert voor een reeks theragrippers, de activeringslaag tonend, drug-eluerende laag, en de thermoresponsieve trigger. (B) SEM-afbeelding met theragrippers naast de punt van een 22-gauge injectienaald. De theragrippers zijn klein genoeg om veilig door het maagdarmkanaal te gaan zonder enige maagobstructie te veroorzaken. (C) SEM-afbeelding met een enkele 250 m, as fabricated theragripper with the drug-encapsulated chitosan patch at the center and the paraffin wax trigger layer on the hinges. (D) High-resolution SEM image showing the surface morphology of the chitosan patch at the center of the theragripper. The patch has pores less than 100 nm in size. (E) Release characteristics of ketorolac (KT) from theragrippers of four different sizes. (F) Plot showing the relative scaling of the drug loading capacity of theragrippers of different sizes. The entire loaded drug gets released over a period of 24 hours. While the 250-μm theragrippers were used for our in vivo experiments in rats, larger 1.5-mm theragrippers can be loaded with about 100 times more drug, for use in larger animal models and humans. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb4133
Ex vivo and in vivo attachment followed by systemic drug delivery
The team performed ex vivo (experiments on tissue conducted externally in a laboratory) theragripper attachment studies using rat colon tissue and visualized surface penetration using scanning electron microscopy (SEM). During in vivo experiments in rats, Ghosh et al. deployed thousands of grippers in a single shot by using a pneumatic microfluidic controller (PMC). The team delivered the drug deploying theragrippers intrarectally via a pneumatic delivery system to jugular vein cannulated rats. The rat colon appeared normal at the sites of attachment, indicating the absence of tissue damage or inflammation. The team also conducted similar experiments with a porcine (pig) model to understand theragrippers as a resident device in the upper GI tract. During these investigations, the device transited through the esophagus in less than a minute and remained attached to the colon for up to a day. All experiments demonstrated the safe elimination of the grippers from the body through natural mucosal turnover. Each theragripper contained approximately 23 nanograms of ketorolac for sustained drug concentrations and showed delayed clearance compared with pristine ketorolac.
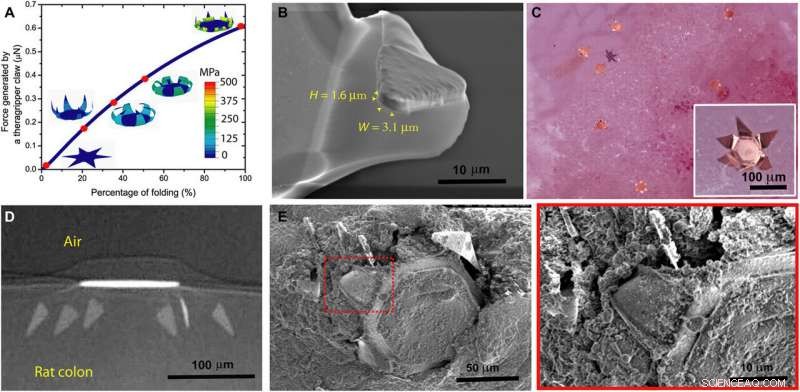
Theragrippers can apply sufficient force to penetrate the mucosa. (A) Plot of the force generated by a theragripper as a function of the percentage of folding, generated by FEM. Each claw of the theragripper can generate a maximum force of around 0.6 μN per hinge. Insets show the simulated configurations at different stages of the folding process marked by red dots. The colors in the legend indicate the magnitude of the von Mises stress in the gripper. (B) Close-up SEM image of the tip of a theragripper, showing the cross section of the tip having a width (W) of approximately 3.1 μm and a height (H) of 1.6 μm. To estimate the pressure exerted by this tip as the gripper actuates, we used the Hertz contact mechanics model and assumed the tip to be a sphere of diameter 1.6 to 3.1 μm. (C) Ex vivo experiment showing many theragrippers latching onto the colon of a rat. The inset shows the bright-field zoomed-in image of a single theragripper. (D) μ-CT image of the cross section of a theragripper penetrating into the colon ex vivo. (E) SEM image of a theragripper latching onto the colon mucosa ex vivo. (F) Zoomed-in image of the red outlined region in (E), showing the penetration of the claw into the colon tissue. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abb4133
Op deze manier, Arijit Ghosh and colleagues developed a versatile platform of thermoresponsive theragrippers for drug dispersion in smaller conduits within the body. The team markedly improved the performance by altering the geometry, hydrogel matrix and drug formulation to observe drug release and the retention of grippers in the colon for 24 hours. Due to the thermoresponsive nature of theragrippers, the team will need to refrigerate the devices for immediate and long-term storage. They conducted proof-of-concept studies with the model drug ketorolac, which showed an increased half-life of almost 12 hours, the concept can be extended to other drugs. The new and versatile theragripper drug delivery system is based on self-latching in live animals and presents a new paradigm in drug administration.
© 2020 Wetenschap X Netwerk
 Nieuw materiaal verlaagt het energieverbruik in verband met de productie van ethyleen
Nieuw materiaal verlaagt het energieverbruik in verband met de productie van ethyleen Biochemici simuleren een functionele dans die eiwitvouwt chaperonnes
Biochemici simuleren een functionele dans die eiwitvouwt chaperonnes Video:Hoe kom je van die stinkdiergeur af?
Video:Hoe kom je van die stinkdiergeur af? Nieuw materiaal breekt wereldrecord voor het omzetten van warmte in elektriciteit
Nieuw materiaal breekt wereldrecord voor het omzetten van warmte in elektriciteit Enkele vingerafdruk op plaats delict detecteert klasse A-drugsgebruik
Enkele vingerafdruk op plaats delict detecteert klasse A-drugsgebruik
 Stadsplanning voor sub-Sahara Afrikaanse steden heroverwegen
Stadsplanning voor sub-Sahara Afrikaanse steden heroverwegen Klimaatverandering:hoe slecht kan de toekomst zijn als we niets doen?
Klimaatverandering:hoe slecht kan de toekomst zijn als we niets doen? Upgrade van poolijsmodel ten behoeve van poolonderzoek, industrie en leger
Upgrade van poolijsmodel ten behoeve van poolonderzoek, industrie en leger Feminisering van wilde mannelijke forel in Denemarken blijkt om te keren
Feminisering van wilde mannelijke forel in Denemarken blijkt om te keren Overmatige regen veroorzaakte 2018 vulkaanuitbarsting Kīlauea, studie vondsten
Overmatige regen veroorzaakte 2018 vulkaanuitbarsting Kīlauea, studie vondsten
Hoofdlijnen
- Beschermde zones van het Great Barrier Reef helpen vissen in zelfs licht geëxploiteerde gebieden
- Stappen van DNA-transcriptie
- RNA-mutatie vs. DNA-mutatie
- Studie onderzoekt de impact van leeuwen die naast giraffenpopulaties leven
- Monitoring van microben om marsonauten gezond te houden
- Wetenschap verklaart de kleur van je kerst
- Parasitaire planten vertrouwen op een ongebruikelijke methode om hun zaden te verspreiden
- Hadley Cell Effects
- Urban Coopers-haviken overtreffen hun landelijke buren
- Onderzoekers onthullen complexe defectstructuur van Li-ion-kathodemateriaal
- Wetenschappers identificeren chemische oorzaken van vervaging van batterijcapaciteit
- Een methode om kristallen te construeren met een grote fractie reactieve facetten

- Nieuw ontdekt materiaal kan slijtage van buitenaardse voertuigen verminderen

- Wolfraamsuboxide verbetert de efficiëntie van platina bij de productie van waterstof
 Kust-ecosystemen hebben last van stroomopwaartse hydro-elektrische dammen
Kust-ecosystemen hebben last van stroomopwaartse hydro-elektrische dammen Inwoners van Big Island worstelen een jaar na historische uitbarsting
Inwoners van Big Island worstelen een jaar na historische uitbarsting Copernicus Sentinel-2B vangt Brindisi, Italië
Copernicus Sentinel-2B vangt Brindisi, Italië Snelle test om astma te diagnosticeren
Snelle test om astma te diagnosticeren Afbeelding:Proba-V zicht op Galápagos
Afbeelding:Proba-V zicht op Galápagos Centrale banken gewaarschuwd om risico's van virtuele valuta af te wegen
Centrale banken gewaarschuwd om risico's van virtuele valuta af te wegen Typen woestijngrond
Typen woestijngrond  een snellere, goedkopere methode om transistors en chips te maken
een snellere, goedkopere methode om transistors en chips te maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

