
Wetenschap
Waarom zijn er H3O?
1. Waterpolariteit:
* Watermoleculen (H2O) zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (waterstofatomen) en een enigszins negatief uiteinde (zuurstofatoom).
* Met deze polariteit kunnen watermoleculen elkaar aantrekken door waterstofbinding.
2. Protonoverdracht:
* Wanneer een zuur (een protondonor) oplost in water, schenkt het een proton (H+) aan een watermolecuul.
* Dit proton (H+) bestaat niet vrij in oplossing; Het wordt bevestigd aan het zuurstofatoom van een watermolecuul, waardoor H3O+wordt gevormd.
3. Evenwicht:
* De reactie tussen water en een proton is een evenwicht:
* H2O+ H+ ⇌ H3O+
* Dit evenwicht betekent dat er in elke waterige oplossing altijd wat H3O+ aanwezig zal zijn.
4. Belang van H3O+:
* De concentratie van H3O+ in een oplossing bepaalt de zuurgraad.
* De pH -schaal is een logaritmische maat voor de concentratie van H3O+ ionen:
* Lage pH (hoge H3O+ concentratie) =zuur
* Hoge pH (lage H3O+ concentratie) =BASIC
Samenvattend:
H3O+ vormt wanneer een proton (H+) uit een zuur wordt geschonken aan een watermolecuul vanwege de polariteit van water en de neiging van protonen om te binden met elektronenparen. Dit proces is cruciaal voor het begrijpen van zuurbasischemie en de pH van oplossingen.
 Molfracties berekenen met massapercentage
Molfracties berekenen met massapercentage  Wetenschappers creëren katalysatoren met één atoom voor efficiënte elektro-oxidatie van water
Wetenschappers creëren katalysatoren met één atoom voor efficiënte elektro-oxidatie van water  Onderzoekers maken beelden met hoge resolutie van magnesiumionen die interageren met het genbewerkingsenzym CRISPR
Onderzoekers maken beelden met hoge resolutie van magnesiumionen die interageren met het genbewerkingsenzym CRISPR  Waarom kun je een gas pletten?
Waarom kun je een gas pletten?  Moeten we een film maken waar het publiek van geniet of moeten we een Oscar-nominatie binnenhalen? Onderzoek onthult de logica van studio's
Moeten we een film maken waar het publiek van geniet of moeten we een Oscar-nominatie binnenhalen? Onderzoek onthult de logica van studio's
 Onderzoek naar de economische waarde van bomen, sociale en ecologische voordelen
Onderzoek naar de economische waarde van bomen, sociale en ecologische voordelen Lijsten van dingen te vinden in een natuurwonderij Hunt voor tieners
Lijsten van dingen te vinden in een natuurwonderij Hunt voor tieners Orkaanwaarschuwingen terwijl de Amerikaanse Golfkust zich schrap zet voor Gordon
Orkaanwaarschuwingen terwijl de Amerikaanse Golfkust zich schrap zet voor Gordon Duitsland steunt bio-economie met 3,6 miljard euro
Duitsland steunt bio-economie met 3,6 miljard euro Afwatering van veengebieden in Zuidoost-Azië draagt bij aan klimaatverandering
Afwatering van veengebieden in Zuidoost-Azië draagt bij aan klimaatverandering
Hoofdlijnen
- Wat zijn twee voorbeelden van hoe anaërobe ademhaling wordt gebruikt in de voedsel- en drankenindustrie?
- Japanse sake:de nieuwe opkikker? Giststam maakt vermoeidheidsbestrijdende aminozuren aan
- Welke dieren doorloopt metamorfose?
- Stambomen van bloedcellen geven aan hoe de productie verandert naarmate we ouder worden
- Licht schijnen op het sociale leven van virussen
- Waarom falen de besturen van sommige organisaties? Het kan zijn hoe bestuurders hun expertise en verantwoordelijkheden waarnemen
- Kenmerken van micro-organismen
- De atomaire structuur onthult hoe cellen omgevingssignalen vertalen
- Wat maakt Geans?
- Een nieuwe methode om zwavel in complexe moleculen te installeren

- Nieuwe synthesemethode levert afbreekbare polymeren op

- Cryo-EM onthult kroonachtige structuur van eiwit dat verantwoordelijk is voor het reguleren van de bloedstroom
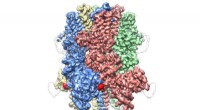
- Nieuwe studie onthult ladingsoverdracht op het grensvlak van spineloxide en ceria tijdens oxidatie van koolmonoxide

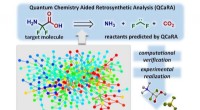
- Nieuwe computerondersteunde chemische synthesemethode vermindert onderzoekstijd en kosten
 Onderzoekers onderzoeken hoe de drijvende krachten achter de klimaatverandering de methaan- en lachgascycli in de oceaan hervormen
Onderzoekers onderzoeken hoe de drijvende krachten achter de klimaatverandering de methaan- en lachgascycli in de oceaan hervormen  Wie zijn Apollo's vrienden?
Wie zijn Apollo's vrienden?  Tweehonderd jaar later,
Tweehonderd jaar later,  Bereken reductie verhouding
Bereken reductie verhouding  Onderzoekers onthullen geschiedenis door opgraving van Otago-graven
Onderzoekers onthullen geschiedenis door opgraving van Otago-graven De VN brachten net een nieuw klimaatrapport uit - en we hebben twaalf jaar gehad om een klimaatramp te beperken
De VN brachten net een nieuw klimaatrapport uit - en we hebben twaalf jaar gehad om een klimaatramp te beperken  Hoe je over klimaatverandering kunt praten, zodat mensen actie ondernemen
Hoe je over klimaatverandering kunt praten, zodat mensen actie ondernemen  Onderzoekers ontdekken hoe kleine plastics door het milieu glippen
Onderzoekers ontdekken hoe kleine plastics door het milieu glippen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

