
Wetenschap
Cryo-EM onthult kroonachtige structuur van eiwit dat verantwoordelijk is voor het reguleren van de bloedstroom
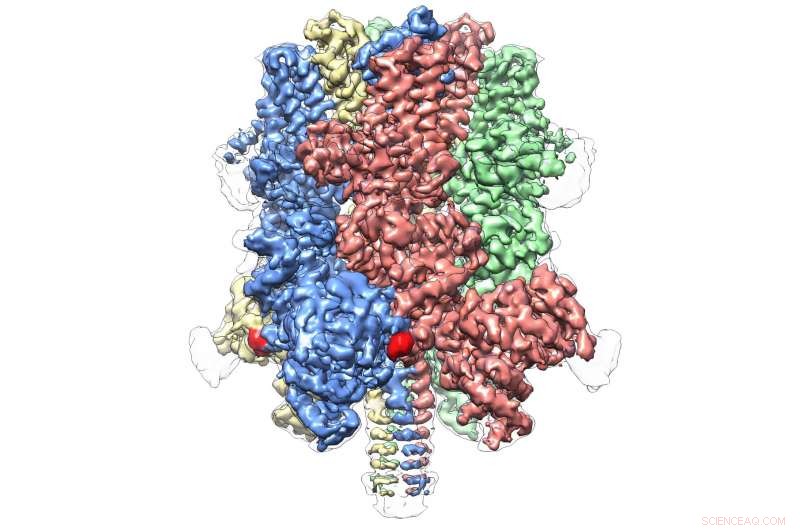
Humaan TRPM4 bond met de agonist Ca+ en modulator DVT bij 3,8 . Krediet:Wei Lu, doctoraat
Een team onder leiding van wetenschappers van het Van Andel Research Institute (VARI) heeft voor het eerst de structuur op atomair niveau onthuld van een veelbelovend medicijndoelwit voor aandoeningen zoals beroerte en traumatisch hersenletsel.
TRPM4 genoemd, dit eiwit wordt in weefsels door het hele lichaam aangetroffen, inclusief de hersenen, hart, nier, dikke darm en darmen, waar het een belangrijke rol speelt bij het reguleren van de bloedstroom via bloedvatvernauwing, evenals bij het instellen van het hartritme en het matigen van immuunresponsen.
"Het is van vitaal belang om de rol te begrijpen die TRPM4 speelt bij het reguleren van de bloedsomloop, maar jarenlang wordt het onderzoek beperkt door een gebrek aan inzicht in de moleculaire architectuur, " zei Wei Lu, doctoraat, een assistent-professor bij VARI en hoofdauteur van een studie die de structuur van TRPM4 beschrijft, vandaag gepubliceerd in Natuur . "Onze bevindingen geven niet alleen een gedetailleerd, kaart op atomair niveau van dit cruciale eiwit, maar onthullen ook volledig onverwachte facetten van zijn make-up."
TRPM4 is van cruciaal belang bij het reguleren van de bloedtoevoer naar de hersenen, die slechts ongeveer 2 procent van het totale gewicht van het lichaam uitmaakt, maar toch 15 tot 20 procent van zijn bloedtoevoer ontvangt. Aandoeningen die de bloedstroom in de hersenen verstoren, zoals een beroerte, traumatische hersenschade, hersenoedeem en hypertensie, verwoestende gevolgen kunnen hebben en aanzienlijke volksgezondheidsproblemen kunnen zijn.
"Er zijn veel waarborgen in de bloedsomloop van de hersenen om te beschermen tegen een plotselinge onderbreking van de bloedtoevoer, een daarvan is TRPM4, " zei Lü. "We hopen dat een beter begrip van hoe dit eiwit eruit ziet, wetenschappers een moleculaire blauwdruk zal geven waarop ze het ontwerp van effectievere medicijnen met minder bijwerkingen kunnen baseren."
De structuur van TRPM4 verschilt aanzienlijk van de andere moleculen in de TRP-superfamilie, een categorie eiwitten die reacties op sensaties en zintuiglijke prikkels mediëren, zoals pijn, druk, visie, temperatuur en smaak. Algemeen bekend als ionenkanalen, eiwitten zoals TRP nestelen zich in celmembranen, fungeren als poortwachters voor chemische signalen die de cel in en uit gaan.
Zelfs binnen zijn eigen onderfamilie, die in totaal uit acht moleculen bestaat, TRPM4 blijkt geheel uniek te zijn. De publicatie van vandaag vertegenwoordigt de eerste atomaire weergave van een lid van de TRPM-subfamilie.
Het onthult een kroonachtige structuur, waarbij de vier pieken een groot N-terminaal domein vormen - een kenmerk van TRPM-eiwitten. Deze regio, gevonden aan het begin van het molecuul, is een belangrijke plaats van interactie met de cellulaire omgeving en andere moleculen in het lichaam. Aan de andere kant van TRPM4, gewoonlijk het C-terminale domein genoemd, Het team van Lü vond een parapluachtige structuur die werd ondersteund door een "paal" en vier spiraalvormige "ribben" - kenmerken die nog nooit eerder zijn waargenomen.
De bevindingen werden mogelijk gemaakt door VARI's ultramoderne David Van Andel Advanced Cryo-Electron Microscopy Suite, waarmee wetenschappers enkele van de kleinste componenten van het leven tot in de kleinste details kunnen bekijken. VARI's grootste microscoop, de Titan Krios, is een van de minder dan 120 in de wereld en is zo krachtig dat het moleculen 1/10 kan visualiseren, 000ste van de breedte van een mensenhaar.
De structuur van Lü is de tweede moleculaire structuur die is vastgesteld op de Krios van het Instituut sinds de voltooiing van de installatie van de suite eerder dit jaar.
 Wordt je toekomstige kleding gemaakt van algen?
Wordt je toekomstige kleding gemaakt van algen? Onderzoekers gebruiken hele levende cellen als sjablonen om naar bioactieve moleculen te zoeken
Onderzoekers gebruiken hele levende cellen als sjablonen om naar bioactieve moleculen te zoeken Nieuw model voorspelt veranderingen in hout
Nieuw model voorspelt veranderingen in hout Nieuwe op ijzer gebaseerde katalysator verhoogt de omzetting van CO2 naar hogere alcoholen
Nieuwe op ijzer gebaseerde katalysator verhoogt de omzetting van CO2 naar hogere alcoholen Wetenschappers kijken toe hoe kunstmatige atomen samenkomen in perfecte roosters met vele toepassingen
Wetenschappers kijken toe hoe kunstmatige atomen samenkomen in perfecte roosters met vele toepassingen
 Eerste directe bewijs voor een mantelpluimoorsprong van Jurassic vloedbasalt in zuidelijk Afrika
Eerste directe bewijs voor een mantelpluimoorsprong van Jurassic vloedbasalt in zuidelijk Afrika Ontbossing wordt aangedreven door wereldwijde markten
Ontbossing wordt aangedreven door wereldwijde markten Orkaan Douglas op flinterdunne afstand van Hawaï
Orkaan Douglas op flinterdunne afstand van Hawaï Dodental stijgt tot boven 370 bij tsunami-ramp Indonesië
Dodental stijgt tot boven 370 bij tsunami-ramp Indonesië Studie voorspelt een dramatische toename van de jaarlijkse hittedagen in het noordoosten van de VS tegen het einde van de eeuw
Studie voorspelt een dramatische toename van de jaarlijkse hittedagen in het noordoosten van de VS tegen het einde van de eeuw
Hoofdlijnen
- Burgerwetenschap kan trends in de vlinderpopulatie voorspellen
- Nieuwe screeningstechniek stelt veredelaars in staat sneller droogteresistente rassen te ontwikkelen
- Doden lindebomen bijen?
- Wat doet zich voor als de Zygote één minder chromosoom heeft dan het gebruikelijke?
- Dode bomen leven met schimmels
- Soorten organismen die van plantencellen zijn gemaakt
- Japanse wetenschappers kweken medicijnen in kippeneieren
- Enzymen: wat is het? & Hoe werkt het?
- Genotype: definitie, allelen en voorbeelden
- veiliger, duurzamere energieopslag vereist focus op interface van geavanceerde materialen
- De Alexa van de chemie:onderzoekers op schema om een open netwerk te bouwen

- Ingenieurs ontdekken nieuwe rol van water bij productie van hernieuwbare brandstoffen
- Chemici veranderen de richting van de Diels-Alder-reactie volledig

- Ingenieurs maken transistors en elektronische apparaten volledig van draad
 Bestuivingsactiviteiten voor kinderen
Bestuivingsactiviteiten voor kinderen Het lef van een Apple iPhone laat precies zien wat Trump verkeerd doet aan handel
Het lef van een Apple iPhone laat precies zien wat Trump verkeerd doet aan handel Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong
Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong Nieuw rekenmodel van chemische bouwstenen kan de oorsprong van het leven helpen verklaren
Nieuw rekenmodel van chemische bouwstenen kan de oorsprong van het leven helpen verklaren Een vleugje zirkonium om de zon beter op te vangen
Een vleugje zirkonium om de zon beter op te vangen Netwerk van geluiden:nieuw onderzoek onthult het magische geheim van menselijke netwerken
Netwerk van geluiden:nieuw onderzoek onthult het magische geheim van menselijke netwerken De drijvende kracht achter tropische modderstromen
De drijvende kracht achter tropische modderstromen De morele waarde van wildernis
De morele waarde van wildernis
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

