
Wetenschap
Een vaste stof oplost in water meestal een endotherme verandering?
* Endothermische oplossing: Dit betekent dat het proces warmte van de omgeving absorbeert, waardoor de oplossing kouder aanvoelt. Dit gebeurt wanneer de energie die nodig is om de bindingen tussen de moleculen van de vaste stof te doorbreken, groter is dan de vrijgegeven energie wanneer de vaste moleculen interageren met watermoleculen. Voorbeelden zijn:
* Oplost van ammoniumnitraat (gebruikt in koude pakketten)
* Oplost van kaliumchloride
* Exotherme oplossing: Dit betekent dat het proces warmte in de omgeving loslaat, waardoor de oplossing warmer aanvoelt. Dit gebeurt wanneer de energie die wordt afgegeven door de interactie tussen de vaste moleculen en watermoleculen groter is dan de energie die nodig is om de bindingen binnen de vaste stof te doorbreken. Voorbeelden zijn:
* Oplost van natriumhydroxide
* Het oplossen van zwavelzuur
Samenvattend: De enthalpieverandering (warmteverandering) tijdens de oplossing wordt bepaald door de balans tussen de energie die nodig is om de bindingen in de vaste stof te doorbreken en de energie die wordt vrijgegeven wanneer de vaste stof interageert met water.
 Een mengsel dat vormt wanneer de ene stof in een andere oplost?
Een mengsel dat vormt wanneer de ene stof in een andere oplost?  Hoe wordt een koolwaterstof genaamd met Carbonyl Group aan de ene kant?
Hoe wordt een koolwaterstof genaamd met Carbonyl Group aan de ene kant?  Wat is de brandstofbron die wordt gebruikt voor glycolyse?
Wat is de brandstofbron die wordt gebruikt voor glycolyse?  Hoeveel atomen van elk element koolstof en waterstofzuurstof zijn er in het molecuul CH3O2OH?
Hoeveel atomen van elk element koolstof en waterstofzuurstof zijn er in het molecuul CH3O2OH?  Waarom zou de kleur van fenolftaleïne langzaam kunnen verdwijnen, zelfs nadat al het zuur is getitreerd?
Waarom zou de kleur van fenolftaleïne langzaam kunnen verdwijnen, zelfs nadat al het zuur is getitreerd?
 Hoe vul je een waterbarometer of stormglas
Hoe vul je een waterbarometer of stormglas Veranderingen in jetstream kunnen extreme weersomstandigheden tegen 2060 versterken
Veranderingen in jetstream kunnen extreme weersomstandigheden tegen 2060 versterken Het toepassen van de brandstofefficiëntienormen van de auto-industrie op de landbouw kan miljarden opleveren
Het toepassen van de brandstofefficiëntienormen van de auto-industrie op de landbouw kan miljarden opleveren Onderzoekers vinden zeebodemvalleien onder West-Antarctische gletsjers
Onderzoekers vinden zeebodemvalleien onder West-Antarctische gletsjers Fietssucces kan de sleutel zijn om vijfde van landbouwgrond vrij te maken
Fietssucces kan de sleutel zijn om vijfde van landbouwgrond vrij te maken
Hoofdlijnen
- Hoe bacteriën informatie opslaan om virussen te doden (maar niet zichzelf)
- Vrijgen van genetische parasieten kan leiden tot nieuwe verdediging tegen gevaarlijke bacteriën
- Natuuronderzoek laat zien hoe moleculen uit de kern ontsnappen
- Wat is een voorbeeld van een presynaptische cel?
- In Zuid-Afrika zouden kleine primaten moeite kunnen hebben om zich aan te passen aan de klimaatverandering
- Wat zijn opportunistische parasieten?
- Wat is vergelijkbaar met het weefsel van de planten?
- Het boodschapper-RNA doden -- Maar welke?
- Evolutie hoe werkt
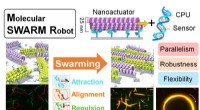
- Wetenschappers werken eraan om robots ter grootte van een molecuul samen te laten zwermen om taken uit te voeren
- Eén enkel enzym induceert de chemische verdediging van een paddenstoel tegen larven

- Onderzoekers ontdekken medicijn dat hersenceldood kan bestrijden bij mensen met de ziekte van Alzheimer
- Nabij-infrarood reflecterende mengcoatings hebben betere optische en koelprestaties

- Kooldioxidemineralisatie in geologisch veel voorkomende gesteenten voor koolstofopslag

 Hoe worden vulkanenuitbarstingen gemeten?
Hoe worden vulkanenuitbarstingen gemeten?  Studie biedt een nieuw antwoord op de vraag waarom de atmosfeer van de aarde zuurstofrijk werd
Studie biedt een nieuw antwoord op de vraag waarom de atmosfeer van de aarde zuurstofrijk werd  Welk werk leverde bewijs van bewegende continenten waardoor de continentale drifttheorie door de wetenschappelijke gemeenschap werd geaccepteerd?
Welk werk leverde bewijs van bewegende continenten waardoor de continentale drifttheorie door de wetenschappelijke gemeenschap werd geaccepteerd?  Bestuderen mariene bioloog de dieren die ze willen?
Bestuderen mariene bioloog de dieren die ze willen?  Salamanders Natuurlijke Habitat
Salamanders Natuurlijke Habitat  Smeltpunten van metalen versus niet-metalen
Smeltpunten van metalen versus niet-metalen  Gratis activiteiten voor het samenstellen van wiskunde
Gratis activiteiten voor het samenstellen van wiskunde  Hoe wordt een kenmerk dat bijdraagt aan weinig of geen nakomelingen niet vaker voorkomt als gevolg van evolutie door natuurlijke selectie?
Hoe wordt een kenmerk dat bijdraagt aan weinig of geen nakomelingen niet vaker voorkomt als gevolg van evolutie door natuurlijke selectie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

