
Wetenschap
Hoe bacteriën informatie opslaan om virussen te doden (maar niet zichzelf)
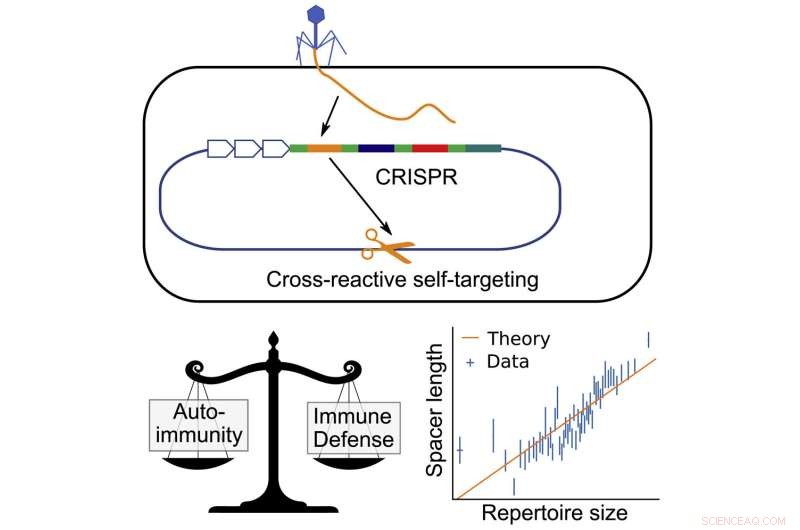
Grafisch abstract. Krediet:Huidige biologie (2022). DOI:10.1016/j.cub.2022.05.021
De afgelopen jaren heeft CRISPR de krantenkoppen gehaald voor het helpen behandelen van patiënten met aandoeningen die zo uiteenlopend zijn als blindheid en sikkelcelziekte. Lang voordat mensen CRISPR echter gebruikten om genetische aandoeningen te bestrijden, gebruikten bacteriën CRISPR als een immuunsysteem om virussen te bestrijden.
In bacteriën werkt CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) door kleine stukjes DNA te stelen van infecterende virussen en die stukjes op te slaan in de genen van de bacteriën. Deze stukjes DNA, spacers genaamd, worden vervolgens gekopieerd om kleine tags te vormen, die zich hechten aan eiwitten die rondzweven totdat ze een bijpassend stukje DNA vinden. Als ze een match vinden, herkennen ze het als een virus en snijden het in stukjes.
Nu, een paper gepubliceerd in Current Biology door onderzoekers van het Department of Physics and Astronomy van de Universiteit van Pennsylvania, toont aan dat het risico op auto-immuniteit een sleutelrol speelt bij het vormgeven van hoe CRISPR virale informatie opslaat, en bepaalt hoeveel spacers bacteriën in hun genen houden en hoe lang die spacers zijn.
Idealiter zouden spacers alleen overeenkomen met DNA dat bij het virus hoort, maar er is een kleine statistische kans dat de spacer overeenkomt met een ander stuk DNA in de bacterie zelf. Dat kan de dood betekenen door een auto-immuunreactie.
"Het adaptieve immuunsysteem bij gewervelde dieren kan auto-immuunziekten veroorzaken. Ze zijn zeer ernstig en gevaarlijk, maar mensen hadden daar niet echt goed over nagedacht voor bacteriën", zegt Vijay Balasubramanian, hoofdonderzoeker van het artikel en de Cathy en Marc Lasry Professor van Natuurkunde in de School of Arts &Sciences.
Door dit risico in evenwicht te brengen, kunnen de bacteriën een soort evolutionaire binding krijgen. Als ze meer spacers hebben, kunnen ze meer informatie opslaan en meer soorten virussen afweren, maar het vergroot ook de kans dat een van de spacers overeenkomt met het DNA in de bacteriën en een auto-immuunreactie veroorzaakt.
Balasubramanian realiseerde zich, samen met coauteurs Hanrong Chen van het Genome Institute of Singapore en Andreas Mayer van University College London, dat de bacteriën dit konden omzeilen door langere spacers te hebben. Net zoals een langer wachtwoord moeilijker te kraken is, zou een langere spacer minder snel overeenkomen met het DNA van de bacterie zelf. Dit betekent dat bacteriën met langere spacers in het algemeen meer spacers zouden kunnen hebben zonder het risico op een auto-immuunreactie.
Met dit idee in de hand bouwden de onderzoekers een wiskundig model om de verhouding te berekenen tussen de lengte van de spacer en het totale aantal spacers dat de bacteriën zouden moeten kunnen opslaan zonder een auto-immuunreactie te riskeren.
Nadat ze het wiskundige model hadden uitgewerkt, controleerden ze of hun voorspelling klopte in echte bacteriën door naar het CRISPR-DNA van duizenden soorten te kijken en de lengte van de spacer te vergelijken met het aantal opgeslagen spacers.
De onderzoekers vonden een consistente, strakke relatie tussen de lengte van de spacer en het aantal spacers.
"De verrassing voor mij is dat het zo verdomd goed overeenkwam toen het net uit de doos kwam", zegt Balasubramanian. "Dit is een heel eenvoudig theoretisch raamwerk. Er is een risico op auto-immuniteit, maar het is fijn om meer immuungeheugen te hebben, en je moet deze twee overwegingen in evenwicht brengen. Het komt gewoon heel, heel zelden voor dat zoiets eenvoudigs overeenkomt met de gegevens."
Balasubramanian zegt dat het succes van het model aantoont dat dit raamwerk van eenvoudige, wiskundige afwegingen van toepassing kan zijn op complexere systemen, zoals het immuunsysteem van gewervelde dieren, inclusief mensen.
"Alleen al door dat soort statistische redeneringen te doen, kun je veel vooruitgang boeken", zegt hij. "Dus misschien kunnen we teruggaan naar de immuniteit van gewervelde dieren en dezelfde technieken gebruiken."
Deze studie is ook een van de eerste die het belang van de auto-immuunrespons bij bacteriën beschrijft. Balasubramanian en zijn medewerkers hopen dat toekomstige studies van CRISPR rekening zullen houden met het risico van auto-immuniteit.
Wat betreft toekomstig werk in zijn groep, hij wil onderzoeken hoe CRISPR informatie opslaat als reactie op evoluerende virussen. En hoewel een statistisch model van evoluerende bacteriële genen misschien ver verwijderd lijkt van het dagelijks leven, zegt Balasubramanian dat dit werk een basis legt voor een breder begrip van immuniteit, op manieren die een dieper inzicht in virussen zoals de seizoensgriep of nieuwe SARS-CoV mogelijk maken. -2 varianten.
Balasubramanian zegt:"Dit zijn allemaal stukjes van een grotere puzzel."
 Materiaalinformatica onthult nieuwe klasse van superharde legeringen
Materiaalinformatica onthult nieuwe klasse van superharde legeringen Wetenschappers gaan nieuwe chemische neuzen maken om het milieu te ontdoen van industriële verontreinigende stoffen
Wetenschappers gaan nieuwe chemische neuzen maken om het milieu te ontdoen van industriële verontreinigende stoffen Chemici ontwikkelen nieuwe methode om eiwitten te identificeren
Chemici ontwikkelen nieuwe methode om eiwitten te identificeren Collageen is bestand tegen meer belasting dan eerder bekend
Collageen is bestand tegen meer belasting dan eerder bekend Sensoren ontwerpen om vreemde lichamen in voedsel te detecteren
Sensoren ontwerpen om vreemde lichamen in voedsel te detecteren
Hoofdlijnen
- Hoe de percentages van adenine in een DNA-streng te berekenen
- Anti-insuline-eiwit gekoppeld aan levensduur en voortplanting bij mieren
- Sneeuwuilaantallen veel lager dan ooit gedacht
- Aardappelziekte chemisch aanvalsmechanisme uitgelegd
- Waar worden vezels gefermenteerd in het spijsverteringskanaal van het varken?
- Is er een verband tussen dankbaarheid en geluk?
- Een 3D-plantencel maken
- Team onthult hoge prevalentie van bacteriën die gen mcr-1 dragen in ecosysteem
- Voordelen en nadelen van klonen
 Coronavirus-moorden:mediaverhaal over huiselijk geweld tijdens lockdown mist het punt
Coronavirus-moorden:mediaverhaal over huiselijk geweld tijdens lockdown mist het punt Balans in het universum brengen:nieuwe theorie zou het ontbreken van 95 procent van de kosmos kunnen verklaren
Balans in het universum brengen:nieuwe theorie zou het ontbreken van 95 procent van de kosmos kunnen verklaren Austin zonne-energie startups visie:zet product op elk dak
Austin zonne-energie startups visie:zet product op elk dak We maken neppoep in een laboratorium – om de sanitaire voorzieningen in Bangladesh te verbeteren
We maken neppoep in een laboratorium – om de sanitaire voorzieningen in Bangladesh te verbeteren Hoe kunstmatige intelligentie het werk opnieuw uitvindt
Hoe kunstmatige intelligentie het werk opnieuw uitvindt Waarom lockdowns niet noodzakelijkerwijs inbreuk maken op de vrijheid
Waarom lockdowns niet noodzakelijkerwijs inbreuk maken op de vrijheid High-end toerisme in Indonesië slaagt er niet in de lokale bevolking tijdens pandemie in hun kracht te zetten
High-end toerisme in Indonesië slaagt er niet in de lokale bevolking tijdens pandemie in hun kracht te zetten Het inferno van binnenkomst overleven, afdaling en landing
Het inferno van binnenkomst overleven, afdaling en landing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com






