
Wetenschap
Waarom worden neon en helium nobele gassen genoemd?
* Volledige buitenste elektronenschillen: De belangrijkste reden is hun elektronenconfiguratie. Zowel neon als helium hebben de buitenste elektronenschalen volledig gevuld. Dit betekent dat ze een stabiele opstelling van elektronen hebben en extreem terughoudend zijn om elektronen te verliezen of te winnen om bindingen te vormen.
* Hoge ionisatie -energie: Er is veel energie voor nodig om een elektron uit een edelgasatoom te verwijderen. Deze hoge ionisatie -energie maakt ze bestand tegen het vormen van positieve ionen.
* Lage elektronenaffiniteit: Nobele gassen hebben ook een zeer lage elektronenaffiniteit, wat betekent dat ze niet gemakkelijk extra elektronen accepteren om negatieve ionen te vormen.
De analogie van een volledig huis: Stel je edelgassen voor als mensen die in een huis wonen met alle kamers comfortabel bezet. Ze hoeven hun ruimte niet te delen of anderen uit te nodigen. Ze zijn inhoud "nobel" en onafhankelijk.
Andere edelgassen: Neon en helium zijn slechts twee leden van de Noble Gas Family, die ook Argon, Krypton, Xenon en Radon omvat. Allen delen dezelfde kenmerken van stabiliteit en lage reactiviteit.
Uitzonderingen: Hoewel edelgassen over het algemeen niet reactief zijn, zijn er enkele uitzonderingen. Xenon kan bijvoorbeeld verbindingen vormen met zeer elektronegatieve elementen zoals fluor en zuurstof.
 Eukaryoten vereisen zuurstof?
Eukaryoten vereisen zuurstof?  Zwavelbindende bacteriën kunnen de sleutel zijn tot het maken van een gemeenschappelijk onderdeel in plastic
Zwavelbindende bacteriën kunnen de sleutel zijn tot het maken van een gemeenschappelijk onderdeel in plastic Ontwikkeling van een nieuwe grootschalige productietechnologie voor sulfide vaste elektrolyten
Ontwikkeling van een nieuwe grootschalige productietechnologie voor sulfide vaste elektrolyten Nieuwe AI-tool versnelt ontdekking van echt nieuwe materialen
Nieuwe AI-tool versnelt ontdekking van echt nieuwe materialen Welke microbe lijken wit op Mannitol Salt Agar?
Welke microbe lijken wit op Mannitol Salt Agar?
 berging logging, aanplant niet nodig om Douglas-sparren te regenereren na Klamath-branden
berging logging, aanplant niet nodig om Douglas-sparren te regenereren na Klamath-branden Hoe gaan krekels in een winterslaapstand wanneer het koud is?
Hoe gaan krekels in een winterslaapstand wanneer het koud is?  Concurrerende relaties in ecosystemen
Concurrerende relaties in ecosystemen  Hoe kon opvolging plaatsvinden in de toendra?
Hoe kon opvolging plaatsvinden in de toendra?  Het leven op aarde is een groot deel van de geschiedenis in duisternis gehouden, studie vondsten
Het leven op aarde is een groot deel van de geschiedenis in duisternis gehouden, studie vondsten
Hoofdlijnen
- Messenger RNA wordt gelezen in groepen van drie. Hoe noemen we deze groepen?
- Enzymen die koolhydraten en lipiden aan eiwitten bevestigen, worden genoemd?
- Welke soort apparatuur wordt gebruikt om DNA te analyseren?
- Welke F -waarde betekent in de microbiologie?
- Wat is de uitgedrukte wanneer geen van beide kopie van een allel volledig maskeert, anders dan in plaats daarvan allelen worden gezien?
- Waar zijn aminozuren in de cel?
- Kunnen ziektedetecterende honden de dikhoornschapen in South Dakota helpen redden?
- Welke cel is ongeorganiseerd?
- Aquatische wiet behoort tot de ergste ter wereld en breidt zich uit in het noordoosten van de VS
- Wetenschappers observeren ultrasnelle geboorte van radicalen

- Nieuwe synthetische biologietools ontgrendelen complexe plantengineering
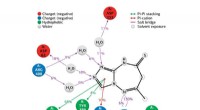
- Chemicus synthetiseert nieuwe verbindingen met sterke antidiabetische eigenschappen
- Lichtgevoelige trigger ontwikkeld voor de geprogrammeerde celdeling en dood
- Synthesestudies transformeren afvalsuiker voor toepassingen voor duurzame energieopslag
 Door licht te vormen, kunnen 2D-microscopen 4D-gegevens vastleggen
Door licht te vormen, kunnen 2D-microscopen 4D-gegevens vastleggen Magnetische nanodeeltjes kunnen de warmteafvoer helpen
Magnetische nanodeeltjes kunnen de warmteafvoer helpen Problemen met hoge waterstanden
Problemen met hoge waterstanden Een platform voor stabiele quantum computing, een speeltuin voor exotische natuurkunde
Een platform voor stabiele quantum computing, een speeltuin voor exotische natuurkunde SpaceX-vlucht naar ISS een dag uitgesteld vanwege het weer
SpaceX-vlucht naar ISS een dag uitgesteld vanwege het weer Kleimineralen op Mars zijn mogelijk gevormd in het oerstoombad
Kleimineralen op Mars zijn mogelijk gevormd in het oerstoombad Juno laat zien dat het magnetische veld van Jupiter heel anders is dan dat van de aarde
Juno laat zien dat het magnetische veld van Jupiter heel anders is dan dat van de aarde Hoe een fractie van een getal te vinden
Hoe een fractie van een getal te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

